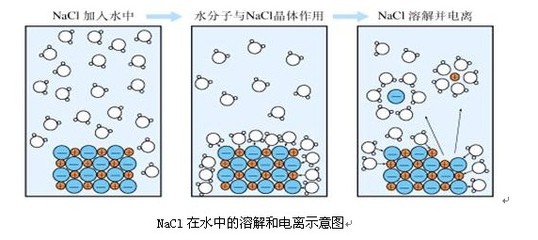
离子反应的本质是某些离子浓度发生改变。下面是小编为您带来的高二化学离子反应知识点,希望对大家有所帮助。
高二化学离子反应知识点(一)1. 离子反应生成微溶物或难溶物。
2. 离子反应生成气体。
3. 离子反应生成弱电解质。
4. 离子反应发生氧化还原反应。
5. 微溶物向难溶物转化,如用煮沸法软化暂时硬水
MgHCO3==MgCO3+CO2↑+H2O
MgCO3虽然难溶,但在溶液中溶解的哪部分是完全电离的,当Mg2+遇到水溶液里的OH-时会结合生成比MgCO3溶解度更小的Mg(OH)2而沉淀析出
MgCO3+H2O==Mg(OH)2 ↓+ CO2↑
6.生成络离子的反应:
FeCl3溶液与KSCN 溶液的反应:Fe3+ + SCN- ==Fe(SCN)2+ 生成物既不是沉淀物也不是气体,为什么反应能发生呢?主要是生成了难电离的Fe(SCN)2+络离子。
7.优先发生氧化还原反应:
具有强氧化性的离子与强还原性的离子相遇时首先发生氧化还原反应。例如:Na2S溶液与FeCI3溶液混合,生成S和Fe2+离子,而不是发生双水解生成Fe(OH)3沉淀和H2S气体。
2Fe3+ + S2- = 2Fe2+ + S ↓
总之:在水溶液里或在熔融状态下,离子间只要是能发生反应,总是向着降低离子浓度的方向进行。反之,离子反应不能发生。
8.确定盐溶液中的离子种类和浓度时要考虑盐的水解。
如Na2S溶液中含有哪些离子,按浓度由大到小的顺序排列:
C(Na+ )>C(S2-)>C(OH-)>C(HS-)>C(H+)
或:C(Na+) +C(H+)=2C(S2-)+C(HS-)+C(OH-)
高二化学离子反应知识点(二)1.离子反应:在水溶液或熔融状态下,有离子参加或生成的反应。
(1)离子反应的发生必须在水溶液或熔融状态下进行,干态条件下不能完成。
(2)离子可以作为反应物,也可以作为生成物。
2.离子反应发生的条件
(1)离子互换非氧化还原反应的离子反应发生的条件:生成物之一是易挥发的物质、难电离的物质或难溶物质。这类反应的共同特征是朝着离子浓度减小的方向移动或者说反应物中某种离子的浓度减小,反应即可发生。此类反应包括:
(2)氧化还原反应型的离子反应发生的条件:反应中有电子转移。
(3)发生离子反应的本质是反应物中某种离子浓度减小。
3.离子反应方程式:用实际参加反应的离子符号来表示离子反应的式子。
(1)一个离子方程式可表达同一类型的所有反应。例如H+ +OH─ == H2O,表示强酸与强碱在溶液中反应生成可溶性盐的所有反应。
(2)在同一体系中进行的反应必须用同一式子进行表达。例如:向硫酸溶液中加入一定量氢氧化钡溶液,应写为:2H+ +SO42─ + Ba2+ + 2OH─ == 2H2O+BaSO4↓,而不能只写出H2O或BaSO4的形成过程。
离子方程式的书写步骤 以次氯酸钠溶液中通入少量的二氧化碳为例 第一步“写”:写出正确的化学反应方程式,并配平。
2NaClO + CO2 + H2O == 2HClO + Na2CO3
第二步“拆”:把在溶液中完全电离的物质写成离子形式。
2Na++2ClO─+CO2+H2O==2HClO+2Na++ CO32─
第三步“删”:删去方程式左右两端不参加反应的离子。
2ClO─ + CO2 + H2O == 2HClO + CO32─
第四步“查”:检查方程式两端是否遵循质量守恒和电荷守恒。 查原子个数、离子电荷是否配平。
4.书写离子方程式时应注意的问题
(1)离子反应是在溶液或熔融状态时进行反应的,凡非溶液中进行的反应一般不能写离子反应方程式,亦即没有自由移动离子参加的反应,不能写出离子反应方程式。如NH4Cl固体和Ca(OH)2固体混合加热,虽然也有离子和离子反应,但不能写出离子反应方程式,只能写化学方程式。
(2)原则上说,电解质要不要拆分改写为离子形式,应以物质客观存在的形式为依据。若化合物主要以离子形式存在,则应“拆”为离子形式表示;若化合物主要以“分子”形式存在,则不能“拆”,而仍应以“分子”形式表示。如浓H2SO4应以分子式表示,稀H2SO4则应“拆”为离子式(2H+和SO42─)表示。
(3)氧化物、弱电解质弱电解质如弱酸(HF、H2S、HClO、H2CO3等)、弱碱(如NH3·H2O)和中强酸(如H2SO3、H3PO4)等难电离的物质必须写化学式;难溶于水的物质〔如CaCO3、BaSO3、FeS、PbS、BaSO4、Fe(OH)3等〕,不能拆为离子式,要用化学式表示。
(4)多元弱酸的弱酸根离子,如 HCO3─、HSO3─等不能再拆(HSO4─除外)
(5)对于微溶物的处理分三种情况:微溶物作为生成物析出的不拆,仍写其化学式,(如Ca(OH)2、CaSO4、Ag2SO4);微溶物作为反应物,若呈混浊液或固态则写其化学式,若呈澄清溶液则拆为离子式表示。
(6)操作顺序或反应物相对量不同时离子方程式不同。如:
①少量烧碱滴入Ca(HCO3)2溶液〔此时碳酸氢钙过量〕中,有:
Ca2+ + HCO3─ + OH─ == CaCO3↓+ H2O
②少量Ca(HCO3)2溶液滴入烧碱溶液〔此时氢氧化钠过量〕中,有: Ca2++HCO3─+2OH─ == CaCO3↓+CO32─+2H2O
(7)一些特殊的反应要注意产物之间的比例关系。例如,硫酸与氢氧化钡的反应中产物H2O与BaSO4的比例关系为2:1。
高二化学离子反应知识点(三)1. 微溶物向难溶物转化,如用煮沸法软化暂时硬水
MgHCO3==MgCO3+CO2↑+H2O
MgCO3虽然难溶,但在溶液中溶解的哪部分是完全电离的,当Mg2+遇到水溶液里的OH-时会结合生成比MgCO3溶解度更小的Mg(OH)2而沉淀析出
MgCO3+H2O==Mg(OH)2 ↓+ CO2↑
2.生成络离子的反应:
FeCl3溶液与KSCN 溶液的反应:Fe3+ + SCN- ==Fe(SCN)2+ 生成物既不是沉淀物也不是气体,为什么反应能发生呢?主要是生成了难电离的Fe(SCN)2+络离子。
3.优先发生氧化还原反应:
具有强氧化性的离子与强还原性的离子相遇时首先发生氧化还原反应。例如:Na2S溶液与FeCI3溶液混合,生成S和Fe2+离子,而不是发生双水解生成Fe(OH)3沉淀和H2S气体。
2Fe3+ + S2- = 2Fe2+ + S ↓
总之:在水溶液里或在熔融状态下,离子间只要是能发生反应,总是向着降低离子浓度的方向进行。反之,离子反应不能发生。
4.定性推断型:主要考查常见阴、阳离子的性质,特别是常见阴、阳离子特殊的物理性质和特征的化学性质必须熟练掌握。
如:(1)特征颜色: Cu2+(蓝
2+3+-2+色)、Fe(浅绿色)、Fe(棕黄色)、MnO4(紫红色)、[Fe(SCN)](红色)、[Fe(C6H5O)6]3-(紫色);
(2)特征现象:焰色反应:K+:紫色(透过蓝色钴玻璃),
Na+:黄色 ;遇OH-生成红褐色沉淀、遇苯酚溶液显紫色、遇SCN-显红色的离子是Fe3+;与碱反应生成白色沉淀,迅速变成灰绿色,最后变成红褐色或遇SCN-颜色无明显变化、通入Cl2后显红色的离子是Fe2+;与NaOH溶液共热,能产生使湿润的红色石蕊试纸变蓝、遇酚酞试液变红的碱性气体的离子是NH4+;加入HBr产生浅黄色沉淀的离子是Ag+或S2-和SO32-组成。
5.离子方程式正误判断规律(八“看”)
⑴看离子反应是否符合客观事实,不可主观臆造产物及反应。
⑵看“=”“≒”“↑”“↓”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3-不能写成CO32-+H+
⑷看是否漏掉离子反应。
⑸看电荷是否守衡。
⑹看反应物或产物的配比是否正确。
⑺看是否符合题设条件及要求。
⑻看物料是否守衡。
 爱华网
爱华网