急性肺血栓栓塞(acute pulmonary thromboembolism )是由于血栓栓子堵塞肺动脉引起心肺循环障碍的病理生理综合征, 发病率仅次于卒中和急性冠脉综合征。肺动脉被栓子堵塞后,由于肺动脉压和右心室后负荷迅速增高,部分病例可以发生急性右心衰竭。而急性肺血栓栓塞形成后,患者1个月内总死亡率约为10%,其中伴右心室扩张肺栓塞患者的死亡率高达30% ,而不伴右心室扩张肺栓塞患者的死亡率仅为5%[1]。因此,右心衰竭是急性肺栓塞患者死亡的主要原因之一,早期发现并合理治疗是改善患者预后的重要途径。
1 临床表现
急性肺栓塞合并右心功能不全的临床表现缺乏特异性,主要取决于肺血管床阻塞部位、栓子大小、多少、病情进展速度以及患者本身的心肺功能状态,可以从无临床症状到血流动力学紊乱甚至猝死。临床上出现肺栓塞三联征(呼吸困难、胸痛、咯血)的患者不超过30%。大面积肺栓塞(massive pulmonary embolism)和次大面积肺栓塞(submassive pulmonary embolism)是引起右心衰竭的主要原因。其中大面积肺栓塞患者往往出现持续性低血压或休克,而次大面积肺栓塞患者血压常可以维持正常[2]。与慢性右心衰竭引起钠水潴留和胃肠道表现不同,呼吸困难、头昏、晕厥往往是急性肺栓塞患者合并右心功能不全的临床表现。如果出现晕厥,常常提示合并血流动力学紊乱,预示病情严重。而胸痛往往是肺小动脉栓塞导致肺梗死的临床表现,不常见于合并右心功能不全的大面积和次大面积肺栓塞患者。肺栓塞合并右心功能不全的常见体征有呼吸增快、心率增快、血压降低、奔马律、颈静脉搏动增强和(或)颈静脉怒张、新出现三尖瓣反流性杂音和紫绀,严重时可出现急性肝淤血致右上腹胀痛等。
2 急性肺血栓栓塞致右心衰竭的病理生理机制
临床上超过一半的急性肺栓塞患者伴有右心结构和功能改变。右心衰竭是评估急性肺栓塞危险程度和预后的重要指标,反映了急性肺栓塞患者血流动力学改变的程度,是肺栓塞整个病理生理过程改变的核心。
2.1 对右心重构的影响
急性肺栓塞患者病情的严重性取决于肺血管床的阻塞程度以及患者本身的心肺功能。一般情况下,如果肺血管床阻塞面积超过30%,就会引起肺血管阻力增加和肺动脉高压;如果肺血管床阻塞面积达到2/3,则引起右心室压力负荷明显增高、并出现心室重构。然而,与慢性肺动脉高压所致的右心重构不同,急性肺血栓栓塞使肺血管阻力在数分钟至数小时内迅速升高,心室重构的特点是右室游离壁扩张、变薄。而慢性肺动脉高压致右心功能不全时,右室重构往往以心肌肥厚为主[3,4](图1)。
图1 急性右心衰竭和慢性右心衰竭心室重构的区别
2.2 对血流动力学的影响
由于右心室壁薄、泵功能差,因此对后负荷增高的代偿能力有限。右心室后负荷增高导致右心室扩张、室壁张力迅速增加、室间隔向左心室方向移位。同时,室壁张力增高时,右室氧耗量增加,引起的右室缺血或梗死会进一步加重右室扩张和功能障碍。而心包急性扩张能力有限,舒张期心室容积保持相对不变。因此,右心室增大、室间隔向左移位和心包腔压力增高,共同引起了左心室舒张受限、充盈受阻,进而导致心输出量下降和血压降低[5]。当右心输出量下降超过20%时,可继发急性左心功能不全及体循环低血压,最终进展为心源性休克和循环衰竭(图2)
图2 急性肺栓塞对血流动力学影响的机制
2.3 对心肌灌注和炎症反应的影响
半个世纪前,根据急性肺栓塞与心肌梗死可出现某些类似的心电图改变,人们就推测急性肺栓塞可能并发心肌缺血[6]。后来,动物实验和临床试验发现,急性肺栓塞会使冠脉灌注压降低,引起心内膜下缺血[7,8]。近来,由于肺栓塞诊治的规范化,临床确诊肺栓塞的病例数显著增多,发现其中约30-50%的患者可伴有肌酸激酶同工酶(CK-MB)、肌钙蛋白及肌红蛋白等标记物升高。Giannitsis 等对56例急性肺栓塞患者进行研究,发现其中有18例(32%) 伴有肌钙蛋白T升高[9]。同样,Meyer等对36 例临床诊断肺栓塞的患者进行分析,发现超过1/3的患者伴有肌钙蛋白T升高[10]。Konstantinides等报道106例诊断肺栓塞的患者中,有41%出现肌钙蛋白I升高,37%伴肌钙蛋白T升高[11]。因此有学者进一步提出急性肺栓塞不仅可以影响血流动力学,还可继发心肌细胞损伤的观点。
Cuenoud[12]等通过电镜技术,进一步证实了肺栓塞后心肌细胞会出现超微结构变化。他们发现急性肺栓塞后心肌细胞可出现糖原减少、线粒体肿胀等“缺氧”样改变,严重者还可出现线粒体破裂等不可逆损伤。急性肺栓塞时,心肌细胞转化为促炎表型,释放大量炎症因子,加重心肌损害。JA Watts[13]等通过建立大鼠急性肺栓塞模型,发现肺栓塞导致的急性右心功能障碍与趋化因子表达增加、单核/巨噬细胞浸润有关。Orde MM[14]等回顾分析了28例因肺栓塞死亡并进行过尸检的病例,免疫组化分析发现肺栓塞后右室部位出现炎症细胞浸润,以巨噬细胞和T细胞为主。还有研究表明联合阻断5-羟色胺和血栓烷A2,能显著降低兔子肺栓塞后死亡率。因此,与慢性肺动脉高压所致的右心功能不全不同,伴发的炎症反应是急性肺栓塞致右心功能不全的重要特点。而急性肺栓塞继发心肌细胞损害与临床预后的关系也受到普遍关注,心肌损伤标志物肌钙蛋白已成为临床评估肺栓塞预后的重要指标。
因此,急性肺血栓栓塞不仅可在极短时间内引起心肌重构和血流动力学紊乱,还使心肌灌注受损,刺激并放大炎症反应。循环失代偿和心肌发生不可逆损伤,是临床上急性肺栓塞合并右心衰竭时死亡率显著增高的重要原因。
3 急性肺血栓栓塞致右心衰竭的评价方法
急性肺栓塞临床表现缺乏特异性,因此容易发生误诊和漏诊。自美国和欧洲心脏病学会肺栓塞诊疗指南、我国《急性肺血栓栓塞症诊断治疗专家共识》制定以来[15,16],肺栓塞的诊断已不再是困扰临床医生的难题。而对是否合并右心衰竭除从临床表现判断外,还可结合以下辅助检查进行评价。
3.1 心电图
早在60年前,人们就发现急性肺栓塞时可以出现多种心电图改变。虽然心电图诊断肺栓塞和右心功能不全的敏感性和特异性都很低,对肺栓塞也不具有确诊价值。然而,临床上对明确诊断肺栓塞的患者,如果新近出现SIQIIITIII、右束支阻滞、右侧胸导联T波倒置等心电图表现时,常常提示右心室壁张力增高和右心功能不全。
3.2 超声心动图
超声心动图是评价肺栓塞是否合并右心功能不全的重要辅助检查。急性肺栓塞引起右心室后负荷增高时,超声心动图检查常常能发现以下征象:室间隔和右室游离壁动度减弱;右室/左室面积和容量比例增加;室间隔反常运动等。如果右心室游离壁运动比心尖部弱,常提示右室局部心功能受损。McConnell MV[17]等发现该征象对急性肺栓塞合并右心功能不全的阳性预测值为71%,阴性预测值为96%,诊断右心功能不全的总体准确率为92%。
临床上,心脏超声检查满足以下两个或两个以上指标即可诊断右心功能不全:(1)右室内径>30mm或舒张末期右室内径/左室内径>1;(2)右室游离壁运动减低;(3)右室漏斗部运动减低而心尖部运动正常;(4)三尖瓣环收缩位移(TAPSE)<15mm;(5)右房室跨瓣压差>30mmHg。另外,超声心动图还能辅助判断右心衰竭的严重程度。其中室间隔向左心室移位是诊断重度右心衰竭的依据。
3.3 CT肺血管成像(computed tomographic pulmonary angiography,CTPA)
CTPA不仅能判断肺血栓栓塞的部位和范围,还能通过观察心脏和相邻血管形态及参数变化,对右心功能作出评价。同心脏超声检查相似, Quiroz[18]等在CT重建四腔心层面上,发现右室直径/左室直径>0.9与右心室扩大显著相关。Araoz和Kasper[19,20]等发现反常的室间隔位置变化只在肺动脉高压患者中出现, 其中次大面积肺栓塞患者室间隔移位的发生率为54%,而急性大面积肺栓塞患者发生率为74%。因此,室间隔向左室移位和右室/左室增加不仅提示右心功能不全,还说明患者的右心功能不全比较重。各种原因引起的慢性肺动脉高压在CT上也可以表现为室间隔移位, 但与急性肺栓塞不同,该类患者常并存右室壁增厚(>6mm)。因此,室间隔移位但不合并右室壁增厚往往是急性肺栓塞导致右心功能不全的征象。
在血管测量中, 对血流动力学不稳定的严重肺栓塞患者,主肺动脉、上腔静脉和奇静脉的平均直径比血流动力学相对稳定的非严重肺栓塞患者高。Collomb[21]等发现主肺动脉平均直径>30mm在急性严重、非严重肺栓塞和非肺栓塞3组中出现的几率分别是55% 、13% 和0%。另外,正常情况下,CT肺动脉图像上很少见到支气管动脉。当支气管动脉直径>1.5mm时, 通常提示支气管动脉扩张。而肺栓塞患者如果出现支气管动脉扩张, 则往往预示病情严重, 提示对血流动力学已经产生了显著影响。
CT阻塞指数是CTPA定量评价急性肺栓塞患者肺动脉栓子数量的一种方法, 具有简单、实用及可重复性强的优点,不仅可以明确肺动脉树阻塞的范围与程度,近来研究表明还可以评价右心功能。He[22]等研究发现,CT阻塞指数≥30%诊断右心衰竭的敏感性是81%, 特异性是47% ,阳性预测值是59%, 阴性预测值是72%。 Qanadli等研究了CT阻塞指数与右室扩张及右室/左室之间的关系, 发现CT 阻塞指数≥40% 时,超过90%急性肺栓塞患者出现右室扩张。而右室正常患者中, 肺血管阻塞指数均<40%,提示CT阻塞指数能预测右室扩张。Collomb[21]等发现左室短轴最大径与肺动脉直径及血管阻塞严重指数呈负相关,因此, 左室短轴最大径越小、肺动脉直径越大及CT阻塞指数越高, 则急性肺栓塞越严重。Ghaye[23]等发现CT阻塞指数与右室短轴最大径、左室短轴最大径及右室/左室之间有相关性, 其中右室/左室比例与CT 阻塞指数的相关系数最高。
3.4 心导管检查
心导管检查能准确评价急性肺栓塞时的右心功能不全,其中等容收缩期内压力上升最大速度(+dp/dt)和等容舒张期内压力下降最大速度(-dp/dt)分别作为评价心脏收缩和舒张功能的金标准已得到公认。通过右心漂浮导管技术也能测定右心射血分数、右心舒张末期容积、右室收缩末期容积、每搏输出量、心输出量和心脏指数等指标,可以连续监测右心功能。但其缺点是属于有创检查,且无法显示右心结构及室壁运动异常。
3.5 脑钠肽(BNP)和氨基末端脑钠肽前体(NT-proBNP)
利钠肽系统在心脏结构和功能维持中起着重要的代偿作用,其中研究最多的是脑钠肽(B-type natriuretic peptide,BNP)和氨基末端脑钠肽前体(N-terminal pro-BNP,NT-proBNP)。心室肌细胞在压力负荷增加时,合成含134个氨基酸残基的前脑钠肽原后,迅速剪切掉含有26个氨基酸残基的信号肽,形成BNP前体,之后在循环中进一步分解成BNP和NT-proBNP。与BNP相比,NT-proBNP半衰期长、稳定性好。
研究发现BNP和NT-proBNP升高的程度与心室扩张和压力负荷增高成正比, 与心衰严重程度密切相关。Stefan Kruger[24]等对50例肺栓塞患者进行BNP检测,发现无右心功能障碍的患者较伴有右心功能衰竭患者的BNP水平明显偏低,若BNP水平>90pg/ml,有28.4%的患者合并右心功能不全。Filippo Pieralli[25]等对61例急性肺栓塞患者行床旁BNP检测,发现BNP水平<85pg/ml的肺栓塞患者均不伴有右心功能障碍。BNP水平还能对患者进行危险分层。右心功能不全时,如果BNP>527pg/ml,有55%的可能性发生心源性休克或死亡,当BNP<527pg/ml时,有31%的可能性发生心源性休克或死亡。因此,BNP越高,右心功能不全的程度往往越重。
4 危险分层和治疗进展
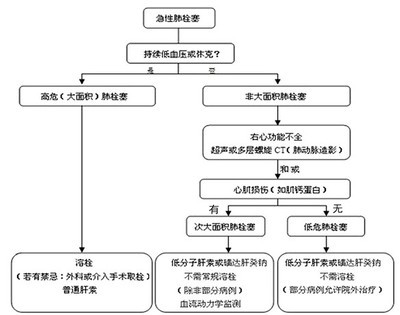
急性肺栓塞临床表现谱宽,对其进行危险分层是合理选择治疗方案的关键。在肺栓塞患者中,大面积肺栓塞患者约占5%,常常合并低血压和休克,住院死亡率高,危险分层属高危(high risk)。大多数肺栓塞患者循环稳定,其中合并右心功能不全和心肌损伤标志物增高的次大面积肺栓塞患者,危险分层属中危(moderate risk),死亡率明显高于无右心功能不全和心肌损伤的低危患者(low risk)。急性肺栓塞合并右心衰竭的治疗方式包括一般治疗、呼吸循环支持、抗凝、溶栓、经导管或外科取栓等,具体治疗方案的选择也与危险分层密切相关(图3)。
图3 急性肺栓塞患者危险分层和治疗方案选择
4.1 一般治疗
密切观察监测生命体征,对于合并焦虑、惊恐的患者适当给予镇静药物,对于胸痛的患者予以止痛治疗,控制液体潴留,减轻心脏前负荷,避免或防止加重心衰的诱因。与急性心肌梗死导致的急性右心功能衰竭治疗不同,急性肺栓塞引起的右心衰竭不主张大量补充血容量,因为对急性肺栓塞患者大量补充血容量会加重心室间相互作用,进一步加重血流动力学异常。大量补充血容量加重室间隔向左室偏移,从而进一步减少心输出量、加重低血压。因此,对急性肺栓塞合并低血压患者,大量补充血容量不能改善血流动力学,反而加重临床表现[5]。
4.2 呼吸循环支持
对合并低氧血症的患者予以吸氧,如果低氧血症无明显改善或出现呼吸衰竭,应积极行机械通气治疗。对合并右心功能不全和心排血量下降的患者,可给予血管活性药物和正性肌力药物,改善心功能和血流动力学。
多巴胺属β受体兴奋剂,具有正性肌力和肺血管扩张效应,能增强右室收缩力、降低肺血管阻力(pulmonary vascular resistance,PVR),是治疗右心功能不全和心源性休克的一线治疗药物。氨力农属磷酸二酯酶抑制剂,也具有正性肌力和血管扩张作用。实验研究表明氨力农能改善狗急性大面积肺栓塞模型的血流动力学,降低肺动脉压力、增加平均动脉压和心输出量,但由于该药半衰期长、个体反应性差异大,要注意监测。目前氨力农改善肺栓塞后右心功能不全的临床研究例数少、尚缺乏充分的循证医学证据支持。
α肾上腺素能血管收缩剂也可用于急性肺栓塞后右心功能不全的患者,虽然其能增加肺血管阻力、恶化右心功能,但能帮助维持体循环血压和冠脉灌注压。去甲肾上腺素同时具有α肾上腺素能受体血管收缩作用和β受体兴奋剂的正性肌力作用,优于单纯的α肾上腺素能受体兴奋剂苯肾上腺素,能够在一定程度上逆转心输出量降低和心肌灌注减少。
4.3 抗凝治疗
抗凝一直是肺栓塞的基本治疗方式。早在20世纪60年代就发现,对急性肺栓塞患者如果早期不予抗凝治疗,死亡率很高,因此,对所有明确诊断且无出血禁忌症的肺栓塞患者,包括合并右心功能不全的患者,均应给予抗凝治疗;可疑或高度可疑肺栓塞且无出血禁忌症的患者,也应在诊断过程中就开始给予抗凝治疗。
传统的抗凝药主要有三类:维生素K拮抗剂华法林、普通肝素和低分子肝素。这些传统抗凝药物的疗效已被众多临床试验所证实,多年来一直是临床上预防、治疗急性肺栓塞的主要药物。然而,传统抗凝药在药代动力学、药效安全性上存在一定局限性,比如肝素有引起血小板减少和骨质疏松症的副作用,限制了其在部分病人中的应用;同时,使用肝素时需要密切监测部分活化凝血酶原时间(APTT)。相对肝素,低分子肝素不需要检测,引起血小板减少的副作用也明显减少,但对肾功能不全的患者应慎用。肝素、低分子肝素属于非肠道类抗凝药,需要静脉或皮下给药,适合于短期抗凝。华法林是经典的口服抗凝药,多用于肺栓塞患者的长期抗凝。但其起效慢、安全窗窄、受药物和食物影响打,需要频繁监测国际标准化比值(INR),对其临床使用带来了一定局限性。
传统抗凝药物的局限性促进了新型抗凝药的研究和开发。随着对凝血作用机制的深入认识,临床上已经出现了以凝血过程中特定凝血因子或凝血环节为靶点的新型抗凝药。目前新型抗凝药主要有直接凝血酶抑制剂、直接Xa因子抑制剂和间接Xa因子抑制剂等。
4.3.1 直接凝血酶抑制剂
直接凝血酶抑制剂包括水蛭素(hirudin)及其衍生物。水蛭素是迄今已知最强的天然抗凝物质。然而,其抗凝作用虽强,出血发生率也高[26]。水蛭素的临床应用受到限制,但其衍生物得到了迅速发展。来匹卢定(lepirudin)和比伐卢定(bivalirudin)系静脉用药,安全性较水蛭素高,多用于住院患者。西美加群(ximelagatran)和达比加群(dabigatran)系口服抗凝药,其中西美加群尽管在抗凝疗效上等同于华法林,但有6%患者出现了肝功能衰竭,该药于2006年已经停止使用[27]。达比加群口服后经胃肠道迅速吸收,体外、体内试验和临床各项研究均提示具有良好的疗效及药动学特性。RE-COVER研究进一步验证了其临床疗效和安全性。该研究纳入2539例患者,发现给予达比加群 150mg/次,2次/天,连用6个月的临床疗效不劣于华法林,且大出血的发生率达比加群为1.6%、华法林1.9%,二者基本相当[28]。该研究为达比加群的临床应用提供了循证医学证据。由于该药80%通过肾脏排泄,因此肾功能严重不全(肌酐清除率<30ml/min)患者应慎用。
4.3.2 直接Xa因子抑制剂
直接Xa因子抑制剂直接与Xa因子的活性位点相结合,从而抑制其与底物的相互作用。主要代表药物有阿哌沙班(Apixaban)和利伐沙班(Rivaroxaba),均为口服直接Xa因子抑制剂。阿哌沙班能高度选择性抑制游离和结合状态的Xa因子,且具有可逆性,因此该药不仅能预防急性血栓,在晚期血栓治疗上仍然显示较好疗效。目前FDA已经批准该药可以用于预防深静脉血栓形成。同样,利伐沙班对Xa因子也具有高度选择性,既可以抑制呈游离状态的Xa因子,也可抑制结合状态的Xa因子,且其结合Xa因子的活性部位较为紧密但又具有可逆性,同时对血小板聚集没有直接作用,能够以剂量-依赖方式延长活化部分凝血活酶时间(APPT)和凝血酶原时间(PT)。利伐沙班与磺达肝癸钠和肝素的本质区别在于它不需要抗凝血酶III参与,可直接拮抗Xa因子。EINSTEIN研究进一步肯定了利伐沙班的临床疗效。该研究纳入4382名急性肺栓塞患者,给予利伐沙班15mg/次、2次/天、连用3周,此后20 mg/次,1次/天,结果发现利伐沙班组血栓复发率为2.1%,非大出血发生率为10.3%,依诺肝素/华法林组血栓复发率1.8%,非大出血发生率为11.4%,两组相比无显著性差异,而大出血发生率利伐沙班组为1.1%,显著低于依诺肝素/华法林组2.2%(P=0.003)[29]。该研究为利伐沙班作为急性肺栓塞的单一、安全有效抗凝药物提供了循证医学证据。
4.3.3 间接Xa因子抑制剂
间接Xa因子抑制剂需要抗凝血酶作为辅助因子才能发挥其抗凝作用,主要包括磺达肝癸钠(fondaparinux sodium)和艾卓肝素(idraparinux)。磺达肝癸钠是选择性Xa因子抑制剂,通过影响凝血级联反应过程,抑制凝血酶的形成以及纤维蛋白的生成,可通过静脉或皮下给药,皮下给药后吸收迅速完全,生物利用度达100%,最终通过肾脏排出。循证医学研究表明磺达肝癸钠的临床疗效和安全性至少和普通肝素一样[30],美国胸科协会推荐其可短期用于高度疑诊或确诊急性肺栓塞患者的抗凝治疗(IC类)。推荐体重<50Kg为5mg/天,体重50-100Kg为7.5mg/天,体重>100Kg为10mg/天,严重肾功能衰竭患者禁用。艾卓肝素是磺达肝癸钠的衍生物,是一种新的肠道外间接Xa因子抑制剂。因半衰期长,艾卓肝素可每周皮下给药1次,2.5mg/周,较磺达肝癸钠使用更方便。然而,长期使用艾卓肝素虽然可进一步降低复发深静脉血栓的形成,但显著增加了大出血的发生率[31]。
除去上述抗凝药物外,目前还有处于早期研发阶段的新型抗凝药物,如组织因子/VIIa复合物。IXa抑制剂目前正在进行临床试验。随着循证医学证据的积累,对新型抗凝药物的认识更加清晰和明确,新型抗凝药物已经显示了极大的临床应用前景。
4.4 减轻血栓负荷
与单纯抗凝相比,溶栓治疗能溶解血栓、减轻肺动脉阻塞程度、降低右心压力负荷。Come[32]等对急性肺栓塞合并右心功能不全患者进行超声研究,发现溶栓治疗能使心腔大小、右室室壁动度、收缩期室间隔移位、三尖瓣返流等右心功能不全的表现恢复正常。Meyer G[33]等发现溶栓治疗能够快速改善肺血流动力学指标,改善患者早期生存率。此外,溶栓还能降低再梗塞发生率。因此,对急性肺栓塞伴体循环低血压的病人,只要没有溶栓禁忌症,现行2009年美国和欧洲肺栓塞防治指南和我国2010年肺栓塞诊治共识都推荐溶栓治疗。目前常用的溶栓剂和用法见表1,溶栓禁忌症见表2。关于溶栓治疗时间窗,在急性肺栓塞发病48小时内给予溶栓治疗往往能够获得最大的疗效,对于有症状的急性肺栓塞患者,在6-14天内行溶栓治疗仍有一定获益。对于溶栓有禁忌症的患者,经导管碎栓和外科取栓改善心功能,但手术风险高,死亡率高达40%。
表1 常用溶栓剂及用法
药物是否获FDA批准用法
链激酶是250,000U负荷剂量,30分钟滴完,继续100,000U/h,持续12-24小时。
快速给药:150万U2小时快速滴完
尿激酶是4400U/kg负荷量10分钟用完,继续4400U·kg-1d-1,持续12-24小时
快速给药:300万U2小时快速滴完
阿替普酶是100mg,2小时滴完
快速给药:0.6mg/kg,15分钟快速滴
瑞替普酶否20U分两次静脉注射,间隔30分钟
替奈普酶否30-50mg,根据体重调整剂量
<60kg30mg
≥60-<70kg35mg
≥70-<80kg40mg
≥80-<90kg45mg
≥90kg50mg
表2 溶栓禁忌症
绝对禁忌症相对禁忌症
脑出血病史或6月前短暂性脑缺血发作
不明原因脑中风口服抗凝药
6月前缺血性中风怀孕或产后1周内
中枢神经系统肿瘤不可压迫血管穿刺
3周前重大外伤、手术和创伤复苏
头颅外伤难治性高血压(收缩压>180mmHg)
肝病晚期
感染性心内膜炎
活动性消化道溃疡
然而,目前对体循环血压正常但超声或临床表现提示右心功能衰竭的病人,是否应在抗凝治疗的基础上积极给予溶栓治疗尚存争议。为回答这一问题,人们设计并开展了急性肺栓塞溶栓治疗研究(pulmonary embolism thrombolysis ,PEITHO)[34]。从2007年到2012年,该研究纳入欧洲13个国家和以色列的1006例急性肺栓塞合并右心功能不全、同时肌钙蛋白阳性的患者,随机接受肝素+安慰剂或肝素+替奈普酶治疗,观察对主要终点事件(全因死亡和循环衰竭)的影响。2013年ACC大会公布了初步结果,与安慰剂组相比,替奈普酶组主要终点事件发生率降低56%;患者血液动力学不稳定发生率明显下降,接受替奈普酶和安慰剂患者的比率分别为1.6%和5%;两组猝死率分别为1.2%和1.8%,无明显差异;两组大出血发生风险分别为6.3%和1.5%,替奈普酶组较安慰剂组明显增高,替奈普酶组有10例出血性卒中,而安慰剂组仅1例。该研究发现对于75岁以下患者的患者来说,其获益更多,且发生出血性卒中几率更小。该项研究责任人Stavros Konstantinide强烈支持对患者进行危险分层,来权衡患者获益-风险比。Patra S[35]等对130例急性次大面积(血流动力学稳定)肺栓塞患者行替奈普酶溶栓治疗开展了前瞻性观察研究, 83%的患者右心功能得到了恢复和肺动脉压力下降,只有9%的患者因并发症死亡,其中2例死于颅内出血,可能是因为他们纳入的群体年龄偏低有较低的出血风险。Riera-Mestre A[36]等进行了回顾性队列研究,纳入15944例急性肺栓塞患者,对于收缩压小于100mmHg的患者而言,溶栓治疗是有益的(OR=0.72),而对于血压正常的患者而言,溶栓导致的死亡率是明显增加的(OR=2.32)。Fasullo S[37]等对72例次大面积肺栓塞患者进行了随机双盲试验,37例为阿替普酶+肝素组,35例为安慰剂+肝素组。通过超声心动图随访观察早期及180天右心功能指标。阿替普酶组较安慰剂组右心功能得到明显改善,且180天生存率得到了明显提高,出院后随访观察主要死亡事件两组无显著性差异。已有的临床研究提示,对肺栓塞合并右心功能不全的患者,需从患者年龄和血流动力学等多方面进行评估,权衡风险-获益比,从而决定是否进一步溶栓治疗。
虽然目前肺栓塞致右心衰竭的治疗取得了很大进展,但仍有很多问题尚未解决。如炎症在急性肺栓塞后右心功能不全发病中起重要作用,但抗炎治疗是否能保护右心功能尚缺乏研究。另外,选择性肺血管扩张剂是否能改善肺气体交换,减轻室壁张力,是否能改善右心功能尚不清楚。
参考文献
[1] Torbicki A, Perrier A, Konstantinides S, et al. Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 2008,29(18):2276-315.
[2] Jaff MR,McMurtry MS,Archer SL, et al. Management of Massive and Submass-ive Pulmonary Embolism, Iliofemoral Deep Vein Thrombosis, and Chronic Thro-mboembolic Pulmonary hypertension. A Scientific Statement From the American Heart Association. Circulation, 2011,123(16):1788-830.
[3] Haddad F, Hunt SA, Rosenthal DN, et al. Right ventricular function in cardiovas-ular disease, part I: anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation, 2008,117(11):1436-48.
[4] Watts JA, Marchick MR, Kline JA.. Right ventricular heart failure from pulmon-ary embolism: key distinctions from chronic pulmonary hypertension. J Card Fail, 2010,16(3):250-9.
[5] Lualdi JC, Goldhaber SZ. Right ventricular dysfunction after acute pulmonary embolism: pathophysiologic factors, detection, and therapeutic implications. Am Heart J,1995,130(6): 1276-82.
[6] Dalen JE. Pulmonary Embolism: What Have We Learned Since Virchow ? Natural History, Pathophysiology and Diagnosis. Chest, 2002,122(4):1440-56.
[7] Calvin JE , Quinn B. Right ventricular pressure overload during acute lung inju-ry: cardiac mechanisms and the pathophysiology of right ventricular systolic d-ysfunction. J Crit Care, 1989,4(4):251- 265.
[8] Fixler DE, Archie JP, Ullyot DJ, et al. Effects of acute right ventricular systolic hypertension on regional myocardial blood flow in anesthetized dogs. Am Hea-rt J, 1973.85(4):491-500.
[9] Giannitsis E, Müller-Bardorff M, Kurowski V, et al. Independent prognostic va-lue of cardiac troponin T in patients with confirmed pulmonary embolism. Circulation.2000,102(2):211-7.
[10] Meyer T, Binder L, Hruska N, et al. Cardiac troponin I elevation in acute pulm-onary embolism is associated with right ventricular dysfunction. J Am Coll Cardiol, 2000, 36(5): 1632-6.
[11] Konstantinides S, Geibel A, Olschewski M, et al. Importance of cardiac tropon-ins I and T in risk stratification of patients with acute pulmonary embolism. Circulation. 2002,106(10):1263-8.
[12] Cuenoud HF, Joris I, Majno G. Ultrastructure of the myocardium after pulmon-ary embolism. Am J Pathol, 1978,92(2):421-58
[13] John A.Watts, John Zagorski, Michael A.Gellar. Cardiac inflammation contri-butes to right ventricular dysfunction following experimental pulmonary emb-olism in rats. J Mol Cell Cardiol., 2006, 41(2):296-307.
[14] Orde MM, Puranik R, Morrow PL, et.al. Myocardial pathology in pulmonary thrombembolism. Heart, 2011, 97(20):1695-9.
[15] Adam Torbicki, Chairperson, Arnaud Perrier, et al. Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 2008, 29:2276–231
[16] 急性肺血栓栓塞症诊断治疗中国专家共识.中华内科杂志,2010,49(1):74-81.
[17] McConnell MV,Solomon SD,Rayan ME, et.al. Regional right ventricular dysf-unctin detected by echocardiography in acute pulmonary embolism. Am J Cardiol, 1996,8(4):469-73.
[18] Quiroz R, Kucher N, Schoepf UJ, et al. Right ventricular enlargement on che-st computed tomography: prognostic role in acute pulmonary embolism. Circulation, 2004,109(20):2401-4.
[19] Araoz PA, Gotway MB, Trowbridge RL, et al. Helical CT pulmonary angiogr-aphy predictors of in-hospital morbidity and mortality in patients with acute pulmonary embolism. J Thorac Imaging,2003,18(4):207-16
[20] Kasper W, Meinertz T, Henkel B, et al. Echocardiographic findings in patients with proved pulmonary embolism. Am Heart J, 1986,112(6):1284-90.
[21] Collomb D, Paramelle PJ, Calaque O, et al. Severity assessment of acute pulm-onary embolism: evaluation using helical CT. Eur Radiol, 2003,13(7):1508 -14.
[22] He H, Stein MW, Zalta B, et al. Computed tomography evaluation of right hea-rt dysfunction in patients with acute pulmonary embolism. J Comput Assist Tomogr, 2006,30(2):262-6.
[23] Ghaye B, Ghuysen A, Willems V,et al. Severe pulmonary embolism: pulmon-ary artery clot load scores and cardiovascular parameters as predictors of mort-ality. Radiology., 2006,239(3):884-91.
[24] Krüger S, Graf J, Merx MW, et al. Brain natriuretic peptide predicts right hea-rt failure in patients with acute pulmonary embolism. Am Heart J, 2004,147(1):60-5.
[25] Pieralli F, Olivotto I, Vanni S, et al. Usefulness of bedside testing for brain na-triuretic peptide to identify right ventricular dysfunction and outcome in norm-otensive patients with acute pulmonary embolism. Am J Cardiol, 2006,97(9): 1386-90.
[26] Greinacher A, Warkentin TE. The direct thrombin inhibitor hirudin.Thromb Haemost, 2008,99(5):819-29.
[27] Spyropoulos AC. Investigational treatments of venous thromboembolism. Expert Opin Investig Drugs, 2007,16(4):431-40.
[28] Schulman S, Kearon C, Kakkar AK,,et al. Dabigatran versus warfarin in the tr-eatment of acute venous thromboembolism. N Engl J Med, 2009,361(24):2342-52.
[29] Come PC, Kim D, Parker JA, et al. Early Reversal of Right Ventricular Dysfu-nction in Patients With Acute Pulmonary Embolism After Treatment With In-travenous Tissue Plasminogen Activator. J Am Coll Cardiol, 1987,10(5):971-8.
[30] Bauersachs RM. Fondaparinux: an update on new study results. Eur J Clin Invest, 2005,35 Suppl 1:27-32
[31] Buller HR, Cohen AT, Davidson B, et al. Extended prophylaxis of venous thro-mboembolism with idraparinux. N Engl J Med, 2007,357(11):1105-12.
[32] Bauersachs R, Berkowitz SD, Brenner B, et al. Oral rivaroxaban for symptom-atic venous thromboembolism. N Engl J Med, 2010,363(26):2499-510.
[33] Meyer G, Sors H, Charbonnier B, et al. Effects of intravenous urokinase versu-s alteplase on total pulmonary resistance in acute massive pulmonary embolis-m: a European multicenter double-blind trial. The European Cooperative Stud-y Group for Pulmonary Embolism. J Am Coll Cardiol, 1992,19(2):239-45.
[34] Lankeit M, Konstantinides S. Thrombolytic therapy for submassive pulmonaryemblism. Best Pract Res Clin Haematol, 2012,25(3):379-89.
[35] Patra S, Agrawal N, Manjunath CN, et al. Thrombolytic therapy in the treatme-nt of acute submassive pulmonary embolism: a prospective observational stud-y. Blood Coagul Fibrinolysis, 2013,14 [Epub ahead of print]
[36] Riera-Mestre A,Jiménez D,Muriel A,et al. Thrombolytic therapy and outco-me of patients with an acute symptomatic pulmonary embolism. J Thromb Haemost,2012,10(5):751-9
[37] Fasullo S,Scalzo S,Maringhini G, et al. Six-month echocardiographic study in patients with submassive pulmonary embolism and right ventricle dysfunct-ion: comparison of thrombolysis with heparin. Am J Med Sci,2011, 341(1):33-9.
 爱华网
爱华网