相关解答一:化学的化合价怎样算?
基本化合价靠背。
对于化合物来说,未知化合价元素通常按照所有化合价代数和为零
带电离子团中的未知化合价元素是按照各元素化合价代数和为离子带电量来计算
相关解答二:化学的化合价怎么算的
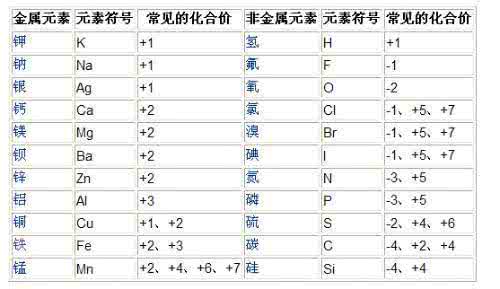
一价氢氯钾钠银。。。口诀你应该有,背下来就行了,以后会明白。
化合价的产生是化合物的形成过程所致,化合物由化学键连接,范德华、离子键、共价键==,会因为共用电子对或者得失电子产生。大学课程无机和结构都会讲。
相关解答三:化学化合价比如NaoH的化合价怎么计算
先记住不变价元素的化合价,比如钠元素在化合物里只有正一价,氢元素化合价也以正一价常见,氧以-2价常见.化合物中元素化合价的代数和等于零(这叫 化合价法则 ),1-2+1=0 正确.就说明以上的化合价正确. 再比如 计算氯酸钾[KClO3]中氯元素的化合价.先标出确定元素的化合价(一般唯一),k +1价;O -2价,根据元素的化合价为零的化合价法则,设氯元素的化合价是x ,则有: 1+x +(-2)X3=0 解得 x=5 即 氯酸钾中氯元素化合价是 +5 .有时根据固定不变的原子团的化合价计算元素的化合价更简洁;如确定氢氧化亚铁[ Fe(OH)2]中铁元素的化合价的方法可以是:氢氧根是-1价,根据化合价法则,Fe(OH)2中Fe是+2价.
相关解答四:有机化学中化合价怎么计算
要根据结构式或结构简式进行计算。以丁烷为例,其结构简式为CH3CH2CH2CH3,根据烷烃中氢元素化合价均为+1(因为有机化学中与氢成键的原子电负性一般大于氢,所以氢在有机物中基本全部显+1价),因为头尾两个碳原子与3个氢原子相连,所以这两个C的化合价为-3价,而碳氢链中间的两个碳分别与2个氢原子相连,所以这两个C显-2价。其他结构更复杂的有机物也应用同样的方法计算。
相关解答五:初三化学化合价计算
1、5个N,总相对原子质量=70,质量分数16.5%,则该分子的相对分子质量=70/16.5%=424
2、A2BO4中,O的总相对原子质量=64,质量分数32.49%,则化合物相对分子质量=64/32.49%=197,2个A原子的总相对原子质量=197*39.6%=78,则一个A原子的相对原子质量=39。B的相对原子质量=197-64-78=56
3、燃烧方程是:2M+O2===2MO
2x 2(x+16)
3.2 4
x=64
4、铁的总相对原子质量=68000*0.33%=224,个数=224//56=4
相关解答六:化学中化合价如何计算?
原子失几个电子化合价就是正几,得几个电子化合价就是负几。
相关解答七:化学式里元素的化合价怎么算?
根据化学式求化合价
依据:化合物中正负化合价的代数和为零
方法:(1)化学式已知时,要确定其中某元素的化合价.可依据常见元素的化合价表,或是依据已知.
例1:已知氢为+1价,氧为-2价,试确定硫酸(H2SO4)中硫元素的化合价.
解:设硫酸中硫元素的化合价为x.
1×2 + x +(–2)×4 = 0
x=+6
答:硫酸中硫元素的化合价为+6.
例2:已知钙为+2价,试求Ca(OH)2是氢氧根的化合价.
解:设氢氧根的化合价为x.
则 2 + 2x = 0
x =–1
答:Ca(OH)2中氢氧根的化合价为–1.
例3:已知碳酸根(CO3)的化合价为-2,试确定碳酸根中碳元素的化合价.
解:在原子团中正负化合价的代数和等于原子团的化合价.设碳元素的化合价为x.
则 x + (–2)×3 = –2
x = +4
答:碳酸根中碳元素的化合价为+4.
是否可以解决您的问题?
相关解答八:初中化学化合价怎么计算
给你一个常用化合价的顺口溜:一价钾钠氯氢银二价氧钙钡镁锌二三铁、二四碳 (铁通常为2或3价,碳通常为2或4价)二四六硫都齐全 (硫常用的价有2、4、6)
相关解答九:初中3年级化学化合价怎么算
依据:化合物中元素正负化合价代数和为零。
方法:先标出固定元素化合价(即只有一个化合价),再设所求元素化合价为X,再列出方程,求出结果。
例题:求H2SO4中硫元素的化合价
解:先标固定元素H、O的化合价+1,-2,设S元素的化合价为X,则:
(+1)X2+X+(-2)X4=0
X=+6
相关解答十:有机化学中化合价怎么计算?
确定元素化合价方法例析
)
中学化学中确定元素的化合价,一般是从常见元素的化合价入手考虑的。例如,确定K2MnO4中Mn元素的化合价,是从K元素为+1价,O元素为-2价入手,然后根据化合物中元素化合价的代数和为零,确定出Mn元素的化合价为+6价。笔者认为,除了熟练常握上述确定元素化合价的方法以外,还应学会从以下几方面来确定元素的化合价。
一.根据物质的结构确定元素的化合价
例1.用稀硫酸酸化的双氧水溶液中,加入乙醚后液体分层,再加入少量重铬酸钾溶液并振荡,在乙醚层中出现深蓝色,这是因为生成的CrO5溶于乙醚所致。CrO5的结构如右图。上述反应的离子方程式为:Cr2O72-
+4H2O2+2H+=2CrO5+5H2O。下列叙述中不正确的是( )
A.Cr2O72- 被氧化成CrO5 B.H2O2被还原成H2O
C.该反应不属于氧化还原反应
D.此反应可用于检验Cr2O72-
分析:解本题的关键是确定Cr元素和O元素的化合价。本题容易错误地把CrO5中O元素的化合价确定为-2价,从而得出Cr元素为+10价,该反应为氧化还原反应,答案选为C。其实,Cr元素与O元素形成共价键时,Cr元素吸引电子对的能力弱于O元素,从CrO5的结构不难看出,Cr与O共形成了6个价键,且有2个过氧键。因此在CrO5中Cr元素的化合价为+6价,其中1个O为-2价,4个O为-1价,反应前后元素的化合价并没有改变。故答案应为A、B。
又如异氰酸(HNCO),其结构是H-N=C=O,由于N元素吸引电子对的能力强于C元素,由结构可看出其中N元素为-3价,C元素为+4价。
例2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构。指出NH5中元素的化合价,并写出其电子式。
分析:N原子、H原子的最外层都符合稀有气体原子的最外层电子结构,可推知N原子应为八电子结构,H原子应为二电子结构,即在NH5中N原子与4个H原子应形成3个共价键,1个配位键,成为铵根离子,另一个H原子应成为阴离子。故在NH5中,N元素为-3价,其中4个H为+1价,另一个H为-1价;NH5的电子式为(如图)。
二.根据元素在周期表中的位置确定元素的化合价
例3.S2O8n-
离子在一定条件下可把Mn2+ 离子氧化成MnO4-离子,若反应后S2O8n- 离子变为SO42-
离子;又已知反应中氧化剂与还原剂的离子数之比为5∶2。则S2O8n-中n的值和S元素的化合价是( )
A.2 ;+7 B.2 ;+6 C.4 ;+7
D.4
;+6
分析:本题易错设S元素的化合价在反应中降低X价,然后根据氧化还原反应中得、失电子总数相等列式,即5×2X=2×5,解得X=1,从而得出S2O8n-离子中S元素的化合价是+7价,由S2O8n-离子中O元素为-2价,求得n=2,得出答案为A。其实,S元素位于元素周期表中的第ⅥA族,由于主族元素的最高正价数等于其族数,所以S元素的最高正价应为+6价,则S元素在反应前后的化合价没有变化,由此可推知作为氧化剂的S2O8n-
离子中必存在着-1价的氧,在反应中-1价的氧元素化合价降低到-2价。设S2O8n-离子中-1价的氧为Y个,根据氧化还原反应中得、失电子总数相等列式,即5×Y=2×5,求得Y=2。因此S2O8n-
离子中-1价的氧为2个,-2价的氧为6个,可求得n=2。正确答案应为B。
又如过硝酸钠(NaNO4)中,N元素位于元素周期表中的第ⅤA族,其最高正价为+5价,由此可推知NaNO4中,有2个氧为-2价,2个氧为-1价。
三.根据元素......余下全文>>
百度搜索“爱华网”,专业资料,生活学习,尽在爱华网
 爱华网
爱华网