高考化学仪器的新宠儿——三颈圆底烧瓶
舞阳县第一高级中学 冯国宏
近几年高考化学实验题的考查,在对常规仪器的考查的同时,常会引入新的仪器来考查学生对仪器使用原理的考查,其中三颈圆底烧瓶备受青睐。
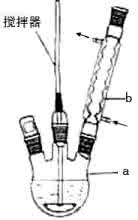
三颈圆底烧瓶是一种常用的化学玻璃仪器,在有机化学实验中被广泛使用。三颈圆底烧瓶通常具有圆肚细颈的外观。它有三个口,可以同时加入多种反应物,或是加冷凝管、温度计、搅拌器等。它的窄口是用来防止溶液溅出或是减少溶液的蒸发,并可配合橡皮塞的使用,来连接其它的玻璃器材。当溶液需要长时间的反应或是加热回流时,一般都会选择使用烧瓶作为容器。烧瓶的开口没有像烧杯般的突出缺口,倾倒溶液时更易沿外壁流下,所以通常都会用玻棒轻触瓶口以防止溶液沿外壁流下。烧瓶因瓶口很窄,不适用玻棒搅拌,若需要搅拌时,可以手握瓶口微转手腕即可顺利搅拌均匀,或是使用专用搅拌机。溶液的体积一般不超2/3,不少于1/3。
【例1】.[15分]二苯基乙二酮常用作医药中间体及紫外线固化剂,可
由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如
下: OOH
CCHOO+2FeCl3CC+2FeCl2+
2HCl
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热
煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程: 加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a___________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:____。
A.缓慢冷却溶液
C.溶质溶解度较小
B.溶液浓度较高 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用__________等方法促进晶体析出。
(3)抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖
1
住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B
.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:___________。
(5)某同学采用薄层色谱(
原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛
细管取样、点样、薄层色谱展开后的斑点如图
所示。该实验条件下比较合适的回流时间是
●
________。
A.15min
C.45min B.30min D.60min 反应开始15min30min45min60min
【参考答案】.[15分]
(1)三颈烧瓶; (球形)冷凝管。
(2)AD;用玻璃棒摩擦容器内壁或加入晶种。
(3)小于;D。
(4)趁热过滤。
(5)C。
【例2】(10分)制备溴苯的实验装置如右图所示,回答下列问题:
(1)反应开始前已向仪器A中加入的药品是 。
装在左侧分液漏斗中的药品是 。
(2)将左侧分液漏斗的旋纽打开后,在A中可观察到的现
象是 。
(3)冷凝管B有上、下两口,冷却水应从 口进入。
(4)右侧分液漏斗中的物质在什么时间加入A中?
。其作用是 。
(5)要证明该反应是取代反应,最方便的实验方法是 。
【答案】(1)铁粉(或三溴化铁)(1分);苯、液溴(只写一个不给分)(1分)
(2)瓶内开始时液面有轻微跳动,慢慢剧烈起来,瓶中出现红棕色气体(2分)
(3)下(2分)
2
(4)反应结束时(1分);除去未反应的溴 (1分)
(5)反应后,取锥形瓶中液体,滴加AgNO3溶液,若产生浅黄色沉淀则得证。(2分)
【解析】略
【例
3】.(15分)
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
实验操作和现象:
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
1为证实各自的观点,在原实验基础上: ○
甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
3
2进行实验,B中现象: ○
检验白色沉淀,发现均不溶于稀盐酸。结合
离子方程式解释实验现象异同的原因:
__________。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_______________。
(5)通过以上分析不难得出SO2与可溶性钡的强酸盐不能反应生成白色BaSO3沉淀。
答案:(1)2H2SO4(浓)+Cu
(2)BaSO4 还原
(3)2NO+O2=2NO2;
(4)①通N2一段时间,排除装置的空气 饱和的NaHSO3溶液
②甲:SO42-+Ba2+=BaSO4↓;乙:2Ba2++2SO2+O2+2H2O=2BaSO4+4H+;白雾的量要远多于装置中氧气的量
(5)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
因此建议同学们在进行化学实验复习的过程中要抓好仪器原理的复习。
△ CuSO4+2H2O+2SO2↑;
4
 爱华网
爱华网