理想溶液
ideal solution
溶液中的所有组分在全部浓度范围内都严格遵守拉乌尔定律的溶液。同分异构体和有机物中的同系物等都能近似构成理想溶液。在理想溶液中,同种分子的分子间力和异种分子的分子间力平均来说都是相等的,即每一种物质的分子与其他分子的相互作用都与纯态时的相互作用相同。因为理想溶液中的所有组分都服从拉乌尔定律,所以它们的化学势具有完全相同的表示形式:
式中μB为溶液中任一组分B的化学势;T为溶液的热力学温度;p为溶液的压力;xB为B的物质的量分数。为标准压力,习惯上取=101.325千帕;为标准压力下与溶液同温的纯B液体的化学势;Vm,B为纯B的摩尔体积。
在一定温度和压力下将多种纯液体相混合形成理想溶液,则该过程具有如下特性:
①无热效应,即:
ΔminH=0(1)式中ΔminH是上述过程的混合焓。配制理想溶液时不吸收或放出热量,这是由于混合前后无分子间力的变化,使每一种物质在溶液中的偏摩尔焓与纯态时的摩尔焓完全相等,因而整个过程没有焓变。
②无体积效应,即:
ΔmixV=0(2)式中ΔmixV是上述过程的混合体积。配制理想溶液时总体积不发生变化,这是由于每一种物质在溶液中的偏摩尔体积完全等于其纯态时的摩尔体积。
③混合熵,即:
(3)式中ΔmixS是上述过程的混合熵;nB是任一组分B的物质的量;xB是B的物质的量分数;R是摩尔气体常数。
④混合吉布斯函数,即:
(4)式中ΔmixG是上述过程的混合吉布斯函数。式(1)~(4)表明,理想溶液的配制过程是一个无功、无热、熵增加、吉布斯函数减少的过程。
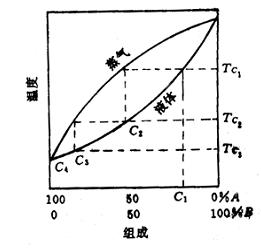
理想溶液的概念及研究具有重要实际意义和理论价值。在处理任意非理想溶液时总是采用与理想溶液相对比的方法。可通过测量实际溶液的ΔmixH或ΔmixV值,发现它与理想溶液的差异,进而讨论和研究溶液的具体性质和规律。以上就是网友分享的关于"理想溶液"的相关资料,希望对您有所帮助,感谢您对爱华网的支持!
 爱华网
爱华网