2015年11月份美国FDA共审批通过10种新药,1类新分子实体药物6个;新生物药物1个;3类新剂型药物3个。
表1 2015年11月份美国FDA审批通过新药
重度嗜酸性粒细胞性哮喘抗体Mepolizumab
2015年11月04日,美国FDA批准了葛兰素史克公司的单抗新药Nucala(Mepolizumab/美泊利单抗)上市,用于重度嗜酸性粒细胞性哮喘的治疗。Mepolizumab(美泊利单抗)是一种实验性全人源化单克隆抗体,特异靶向白细胞介素5(IL-5)。IL-5是一种细胞因子,能够调节嗜酸性粒细胞(白细胞)的生长、活化、存活,并能够为嗜酸性粒细胞从骨髓迁移至肺部及其他器官提供重要的信号。
Mepolizumab与人IL-5结合,阻断IL-5与嗜酸性粒细胞表面受体的结合。以这种方式抑制IL-5对受体的结合作用,能够降低血液、组织、痰液中的嗜酸性粒细胞水平,这反过来又能够降低嗜酸性粒细胞所介导的炎症。Mepolizumab每4周一次皮下注射100mg,常见的不良反应为头痛、虚弱和背疼。
艾滋病新分子实体复方新药Genvoya
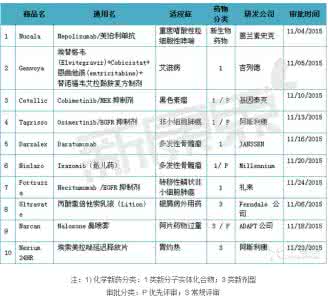
2015年11月05日,美国FDA批准了吉列德公司的新分子实体复方新药Genvoya上市,用于12岁及以上的HIV患者的治疗用药。Genvoya为复方片剂,每片含150mg的埃替格韦(Elvitegravir)、150mg的Cobicistat、200mg的恩曲他滨(emtricitabine)和10mg的替诺福韦艾拉酚胺(TenofovirAAlafenamide)。FDA要求Genvoya的使用人群限于12岁及以上的患者,体重至少达到35公斤(77磅),之前从未针对艾滋病毒进行治疗过,或者艾滋病毒感染但病毒处于抑制状态的成人。
黑色素瘤新分子实体药物Cobimetinib
2015年11月10日,美国FDA通过优先审评途径批准了基因泰克公司的新分子实体药物Cotellic(Cobimetinib)上市,与Vemurafenib联用治疗BRAFV600E或V600K发生突变的黑色素瘤患者。
Cobimetinib是一种口服小分子MEK抑制剂,MEK是一种蛋白激酶,是RAS-RAF-MEK-ERK信号通路的一部分,该通路可促进细胞的分裂和存活,在人类癌症(包括黑色素瘤)中往往处于激活状态。Cobimetinib旨在选择性阻断MEK蛋白的活性,从而阻断其下游的信号通路传导。但是需要注意的是,Cobimetinib不能用于野生型BRAF黑色素瘤的治疗。
非小细胞肺癌新分子实体药物Osimertinib
2015年11月13日,美国FDA通过优先审评途径批准了阿斯利康的新分子实体药物Tagrisso(Osimertinib),用于治疗表皮生长因子受体(EGFR)T790M突变或对其它EGFR抑制剂耐药的晚期非小细胞肺癌患者。Osimertinib为EGFR抑制剂,临床使用前必须首先检测患者是否发生T790M突变。只有T790M突变的非小细胞肺癌患者才能使用Osimertinib展开治疗。
多发性骨髓瘤新分子实体药物Daratumumab
2015年11月16日,美国FDA通过优先审评途径批准了JANSSEN公司的新分子实体药物Darzalex(Daratumumab)上市,用于曾接受过蛋白酶抑制剂和免疫抑制剂治疗但复发的多发性骨髓瘤患者。Daratumumab是抗CD38单克隆抗体,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38分子,可通过多种机制诱导肿瘤细胞的快速死亡。因为健康细胞和所有骨髓瘤细胞均表达CD38,所以用药需要充分考虑药物毒性。
多发性骨髓瘤新分子实体药物Ixazomib
2015年11月20日,美国FDA批准了Millennium公司的新分子实体药物Ninlaro(Ixazomib)上市,与那度胺(lenalidomide)和地塞米松(一种皮质类激素)联用治疗接受过治疗的多发性骨髓瘤患者。Ninlaro是一种蛋白酶体抑制剂,主要是通过抑制多发性骨髓瘤细胞的酶活性从而阻止癌细胞的生长和存活来发挥作用。Ninlaro是第一个口服的蛋白酶体抑制剂。
转移性鳞状非小细胞肺癌新分子实体药物Necitumumab
2015年11月24日,美国FDA批准了礼来公司的新分子实体药物Portrazza(Necitumumab)上市,用于转移性鳞状非小细胞肺癌患者的一线治疗。Necitumumab的上市为晚期鳞状NSCLC群体提供一种额外的一线治疗选择。此前,FDA已授予Portrazza孤儿药地位。Portrazza是一种靶向性抗癌药,旨在干扰某些癌细胞中一种名为表皮生长因子受体(EGFR)的蛋白。EGFR的激活与恶性进展、诱导血管生成、抑制凋亡或细胞死亡相关。阻断EGFR能够从根本上饿死癌细胞,并引发细胞的毁灭。
美国FDA审批新药主要是根据药物化学类型和治疗潜能来进行分类的。新药按化学类型主要分为:1类新分子实体化合物(NME),创新性最强。指在美国从未作为药品批准或销售的活性成分,可以是单一成分,也可以是立体异构混合物中的一部分;2类新的衍生物。从已上市的活性成分(即所谓?专利?药)化学衍生而来,即已在美国上市的活性成分的酯、盐或其它非共价键衍生物,或者是去修饰基团的母体化合物未在美国批准上市的;3类新剂型。含有已上市活性成分的新剂型或新处方,其适应症可以与上市产品相同,也可以不同;4类新组合物。
含有两种或两种以上已上市的活性成分的品种,上市产品中尚无这种组合;5类药物新规格或新生产商;6类新适应症。由同一家公司或其他公司在美国批准或上市的具有新用途的复制品;7类已上市但未经NDA批准的药品。适应症已与上市产品相同,也可不同;8类变为非处方药;9类(NewindicationsubmittedasdistinctNDA-consolidatedwithoriginalNDAafterapproval);10类适应症不同的新的新药申请。
延伸阅读:攀枝花多举措开展食品药品安全宣传药品安全信用体系建设4年内建立内蒙古九项措施并举筑牢食品药品安全防线200余药企撤回药品注册申请 前期研发打了水漂保健品不能代替药品 老年人擦亮眼别被忽悠了安庆 前11月市区查办161起食品药品违法案件 爱华网
爱华网