§ 第三讲 离子反应
【教学目标】
1.能正确辨析电解质、强电解质和弱电解质的概念。 2.了解电解质在水溶液中的电离以及电解质溶液的导电性。 3.能正确书写离子方程式,并判断其正误。 【教学重、难点】
1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。 2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。 【教学内容】
构架
★ 知识点一 电解质 1. 电解质和非电解质的比较
2.强电解质和弱电解质的比较
第 1 页 共 1 页
3. 电离
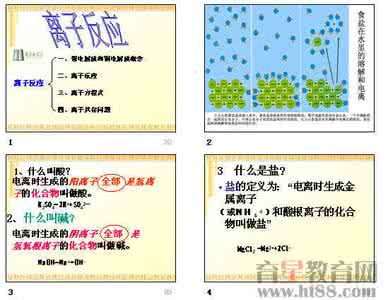
电解质在水溶液中或熔融状态下离解成自由移动离子的过程。 导电原因: 注意:1、其水溶液能导电的物质不一定是电解质,如Cl2、、CO2、SO2、NH3 2、其水溶液导电能力强的不一定是强电解质 3、电离方程书写
4.酸碱盐的定义
酸: 碱: 盐: ★注意:金属导电与电解质溶液导电原因对比
1.金属导电是由于自由电子在电场作用下的定向移动,温度高、金属阳离子振动幅度大,自由电子定向移动阻力增大,金属导电性变弱。
2.电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,决定于溶液中自由移动离子的浓度和离子的电荷数,和电解质的强弱没有必然联系。但温度升高时弱电解质电离程度增大、离子浓度增大、导电性会增强。
第 2 页 共 2 页
★ 知识点二 离子反应和离子方程式
1. 离子反应
(1)
(2)离子反应的条件:生成难溶于水的物质、生成难电离的物质(水、弱酸、弱碱)、生成挥发的物质(气体) 2. 离子方程式
(1) (2)离子方程式的意义
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。 (3)离子方程式的书写 写——拆——删——查 (4)书写离子方程式的注意点 ①微溶物处理方式有三种情况
a.出现在生成物中写化学式,Ca(OH)2; b.做反应物处于溶液状态写离子符号; c.做反应物处于浊液或固态时写化学式。 ②盐类水解的离子方程式不要忘记“H2O”。
③溶液中铵盐与碱反应加热放出NH3↑,不加热写NH3·H2O。
④浓HCl、浓HNO3在离子方程式中写离子符号,浓H2SO4不写离子符号。 ⑤HCO3、HS、HSO3等弱酸的酸式酸根不能拆开写。 ★不拆:弱酸、弱碱、H2O、浓H2SO4、沉淀、气体、 ★查:是否符合事实、质量守恒、电荷守恒 1. 写出下列典型反应的离子方程式:
(1)氯化铝溶液中加入过量氨水
________________________________________________________________________。 (2)小苏打与乙酸溶液混合
________________________________________________________________________。 (3)氧化镁溶于稀硫酸
________________________________________________________________________。 (4)澄清石灰水中加入盐酸
________________________________________________________________________。 (5)Cl2通入水中
________________________________________________________________________。
第 3 页 共 3 页
-
-
-
(6)明矾溶于水发生水解
________________________________________________________________________。 (7)实验室用浓盐酸与MnO2共热制Cl2
________________________________________________________________________。 (8)在石灰乳中加入Na2CO3溶液
________________________________________________________________________。 (9)NH4Cl溶液与NaOH溶液混合
________________________________________________________________________。 (10)浓HNO3与Cu的反应
________________________________________________________________________。 (11)浓H2SO4与Cu混合加热
________________________________________________________________________。 (12)(NH4)2SO4溶液与NaOH溶液混合加热
________________________________________________________________________。 (13)Na2SO4溶液与AgNO3溶液混合
________________________________________________________________________。 (14)NaHCO3溶液与稀盐酸混合
________________________________________________________________________。 (15)NaHSO4溶液与NaOH溶液混合
________________________________________________________________________。 2.多重反应离子方程式的书写
(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:__________________________________。 (2)CuSO4溶液与Ba(OH)2溶液混合:_____________________________________。 (3)NH4HCO3与过量NaOH溶液混合:___________________________________。 (4)Ba(OH)2与H2SO4两稀溶液混合:_____________________________________。 (5)Fe2O3溶于HI溶液中:______________________________________________。 (6)FeBr2溶液中通入过量Cl2:__________________________________________。 (7)FeO溶于稀HNO3中:______________________________________________。 3.酸式盐与碱反应离子方程式的书写 1. NaHCO3溶液与Ca(OH)2溶液反应
(1)NaHCO3少量____________________________________________________; (2)NaHCO3足量___________________________________________________。 2. Ca(HCO3)2溶液与NaOH溶液反应
(1)Ca(HCO3)2少量__________________________________________________;
第 4 页 共 4 页
 爱华网
爱华网