[摘要] 该文采用硅胶和HPLC等色谱手段,从苦参茎叶中分离得到5个化合物,从苦参根中分离得到10个化合物;根据化合物的波谱数据,分别鉴定为corchionoside C(1),丁香苷(2),2′-脱氧胸腺嘧啶核苷(3),松柏苷(4),benzyl O-β-D-glucopyranoside(5),番石榴酸(6),三叶豆紫檀苷(7),苦参酮(8),三叶豆紫檀苷-6′-单乙酸酯(9),槐属二氢黄酮G(10),异腐醇(11),降脱水淫羊藿素(12),4′-甲氧基异黄酮-7-O-β-D-芹糖-(1→6)-β-D-吡喃葡萄糖苷(13),kushenol O(14) 和6″-木糖-染料木素葡萄糖苷(15),其中化合物1~6为首次从该属植物分离得到。
[关键词] 槐属;苦参;异黄酮苦参Sophora flavescens Ait.为豆科槐属植物,在我国主产于河北北部,河南西部,山东西南部以及安徽、湖北、贵州等地[1]。其干燥根作为传统中药苦参入药,始载于汉代《神农本草经》,列为中品;味苦,性寒;具有清热燥湿,杀虫利尿的功效[2];对热痢、便血、尿闭、赤白带下、阴肿阴痒、湿疹、湿疮有良好作用;外用对皮肤瘙痒、滴虫性阴道炎也有很好的疗效[3]。苦参中主要的化学成分为生物碱类、黄酮类、酚酸类、三萜类及少量的苯丙素类和长链脂肪酸类,其中生物碱类和黄酮类被认为是其主要的活性成分,迄今为止,已发现41个生物碱和108个黄酮类化合物。随着对苦参药用资源需求的日益增长,造成了大量苦参地上部分资源的剩余和浪费。为了苦参资源的综合利用与开发,作者对苦参根和茎叶部分进行了化学成分研究,从茎叶中分离得到5个化合物(1~5),从根中分离得到10个化合物(6~15),其中化合物1~6为首次从该属植物中分离得到。
1 材料
Bruker AVIII-600核磁共振仪(北京化工大学核磁共振实验室测定);岛津LC-20A高效液相色谱仪;KQ-3200E型数控超声波清洗器(昆山市超声仪器有限公司);Alltech 426-UV 2000液相色谱仪;Agilent 1200系列LC/MSD液质联用仪。
柱色谱硅胶(100~200,200~300,300~400目青岛海洋化工厂);薄层色谱硅胶GF254(青岛海洋化工厂);葡聚糖凝胶Sephadex LH-20(Sweden);RP-C18(40~75 μm,FU JI silysia chemical LTD.);Agilent C18 HPLC半制备柱(9.6 mm×250 mm,5 μm);Phenomenex Luna C18色谱柱(4.6 mm×250 mm,5 μm)。色谱甲醇和乙腈(Fisher),其他试剂均为分析纯(北京化工厂)。
显色剂为1%硫酸香草醛溶液,FeCl3-K3Fe(CN)6试液;三叶豆紫檀苷对照品购于上海永恒生物制品有限公司,槐属二氢黄酮G和异腐醇对照品由上海复旦大学陈道峰教授馈赠;苦参饮片购于北京人卫中药饮片厂(批号09093001);茎叶于2011年采自山西省长治市,经山西振东集团王瑞珍高级工程师鉴定为豆科槐属植物苦参S.flavescens的茎和叶,植物标本(KSY2011) 保存在中国中医科学院中药研究所。
2 提取分离
苦参茎叶10 kg,20倍量80%乙醇浸泡16 h,加热回流提取4 h,提取液冷却、滤过,滤液减压浓缩至浸膏,然后用水分散,离心,上清液上HPD-100大孔树脂柱,依次用水,30%,50%,70%,95%乙醇洗脱。
30%乙醇洗脱物(60 g),经过硅胶柱色谱分离(10 cm×60 cm,200~300 目),乙酸乙酯-甲醇-氨水(60∶2∶1~15∶2∶1)梯度洗脱,每份300 mL,TLC检测,合并相同组分,得14个流分(3A~3N)。
流分3B(30.323 g)部分,经过硅胶柱色谱分离(6 cm × 50 cm,300~400 目),乙酸乙酯-甲醇-氨水(30∶2∶1~15∶2∶1)梯度洗脱,每份30 mL,TLC检测,合并为5个组分(3B1~3B5),组分3B2(500 mg)经半制备液相纯化,流动相为甲醇-0.1%甲酸水溶液(10∶90,3 mL·min1),得到化合物1(110.1 mg,tR 43 min),2(10.5 mg,tR 36 min);流分3B3(1 060.1 mg)经凝胶柱色谱分离,甲醇-水(2∶3)洗脱,根据薄层板信息合并相同组分,得到3个组分(3B3A~3B3C);流分3B3B(708.4 mg)经半制备液相纯化,流动相为乙腈-0.1%甲酸水溶液(2∶98,3 mL·min1),得到化合物3(36.0 mg,tR 20 min),4(5.1 mg,tR 32 min), 5(6.4 mg,tR 40 min)。
苦参饮片(2.8 kg) 50%乙醇回流提取2次(10,8倍),合并提取液,减压浓缩至无醇味(体积约10 L),静置,离心,上清液用HPD-100大孔树脂柱处理,依次用水,60%,95%乙醇洗脱,得水部位(A,B),60%(C,D,E) ,95%乙醇洗脱部位(F,G)。水部位A依次用水和不同浓度的乙醇反复沉淀,得化合物6粗品(6 g),取出部分经半制备液相纯化,得化合物6单体(30 mg)。60%乙醇洗脱部位E、95%乙醇洗脱部位F和G合并共10 g,经VLC硅胶柱色谱,依次用氯仿∶甲醇(9∶1),氯仿-甲醇-水(60∶10∶1)和甲醇洗脱,得流分E1~E4。E3经重结晶得化合物7(1 009 mg);E1经反复硅胶柱色谱,结合Sephadex LH-20纯化,得化合物8(41 mg),9(18 mg),10(49 mg),11(38 mg);E2经反复Sephadex LH-20柱纯化,得化合物12(4.2 mg)。D部位15 g 经VLC硅胶柱色谱,氯仿-甲醇-水(5∶1∶0.1)洗脱,凝胶柱纯化,结合结晶法得到化合物13(37.2 mg),14(33 mg),15(3 mg)。 3 结构鉴定
化合物1 白色粉末; ESI-MS m/z 409 [M+Na]+,207 [M-glc]+,431 [M+HCOO]-;1H-NMR(CD3OD,600 MHz) δ : 2.55(1H,d,J=16.7 Hz,H-2α),2.05(1H,d,J=16.7 Hz,H-2β),5.76(1H,s,H-4),5.94(1H,d,J=15.5 Hz,H-7),5.65(1H,dd,J=6.4,15.5 Hz,H-8),4.43(1H,dq,J=6.4,6.4 Hz,H-9),1.19(3H,d,J=6.4 Hz,H-10),0.93(3H,s,H-11),0.92(3H,s,H-12),1.82(3H,s,H-13),4.09(1H,d,J=7.8 Hz,H-1′),2.94(2H,m,H-2′,5′),3.03(2H,m,H-3′,4′),3.64(1H,dd,J=7.6,11.7 Hz,H-6′α),3.41(1H,dd,J=6.1,11.7 Hz,H-6′β); 13C-NMR(CD3OD,150 MHz) δ:41.4(C-1),49.8(C-2),197.8(C-3),126.0(C-4),164.2(C-5),78.4(C-6),132.1(C-7),131.9(C-8),72.4(C-9),22.5(C-10),23.6(C-11),24.5(C-12),19.1(C-13),100.4(C-1′),73.8(C-2′),77.6(C-3′),70.5(C-4′),77.5(C-5′),61.5(C-6′)。以上数据与文献[4]报道corchionoside C的数据一致。
化合物2 白色粉末;ESI-MS m/z 767 [2M+Na]+,395 [M+Na]+,193 [M+H-glc]+,417 [M+HCOO]-; 1H-NMR(CD3OD,600 MHz) δ : 6.72(2H,s,H-2,6),6.46(1H,d,J=15.9 Hz,H-7),6.33(1H,dt,J=5.0,15.9 Hz,H-8),4.10(2H,d,J=4.2 Hz,H-9),4.91(1H,d,J=7.2 Hz,H-1′),3.20(2H,dd,J=2.7,5.1 Hz,H-2′,3′),3.14(1H,dd,J=6.0,12.0 Hz,H-4′),3.03(1H,m,H-5′),3.57(1H,dd,J=1.4,11.5 Hz,H-6′α),3.76(6H,s,-OCH3); 13C-NMR(CD3OD,150 MHz) δ: 133.1(C-1),104.9(C-2,6),153.2(C-3,5),134.3(C-4),130.6(C-7),128.9(C-8),61.9(C-9),103.0(C-1′),74.6(C-2′),77.0(C-3′),70.4(C-4′),77.7(C-5′),61.3(C-6′),56.8(-OCH3)。以上数据与文献[5]报道丁香苷的数据一致。
化合物3 白色粉末;ESI-MS m/z 243 [M+H]+,265 [M+Na]+,281 [M+K]+,287 [M+HCOO]-; 1H-NMR(CD3OD,600 MHz) δ: 11.25(1H,s,H-3),1.77(3H,s,5-CH3),7.69(1H,s,H-6),6.16(1H,t,J=6.9 Hz,H-1′),2.06(2H,m,H-2′),4.23(1H,m,H-3′),3.75(1H,d,J=3.1 Hz,H-4′),3.58(1H,dd,J=3.1,11.3 Hz,H-5′α),3.53(1H,d,J=11.3 Hz,H-5′β); 13C-NMR(CD3OD,150 MHz) δ: 150.9(C-2),164.2(C-4),109.8(C-5),136.6(C-6),12.7(5-CH3),84.2(C-1′),40.4(C-2′),70.9(C-3′),87.7(C-4′),61.8(C-5′)。以上数据与文献[6]报道的2′-脱氧胸腺嘧啶核苷数据一致。
化合物4 白色粉末;ESI-MS m/z 365 [M+Na]+,381 [M+K]+,387 [M+HCOO]-; 1H-NMR(CD3OD,600 MHz)δ: 7.05(1H,d,J=1.7 Hz,H-2),7.01(1H,d,J=8.4 Hz,H-5),6.89(1H,dd,J=1.7,8.4 Hz,H-6),6.47(1H,d,J=15.9 Hz,H-7),6.28(1H,dt,J=5.2,15.9 Hz,H-8),4.88(1H,d,J=7.3 Hz,H-1′),3.29(2H,m,H-2′,H-3′),3.15(1H,m,H-4′),3.66(1H,d,J=11.7 Hz,H-6′α),3.45(1H,dd,J=5.6,11.7 Hz,H-6′β),3.78(3H,s,-OCH3); 13C-NMR(CD3OD,150 MHz) δ : 131.5(C-1),110.3(C-2),149.5(C-3),146.5(C-4),115.7(C-5),119.5(C-6),129.5(C-7),128.9(C-8),62.1(C-9),100.5(C-1′),73.7(C-2′),77.3(C-3′),70.1(C-4′),77.5(C-5′),61.1(C-6′),56.1(-OCH3)。以上数据与文献[7]报道的松柏苷数据一致。
化合物5 白色粉末;ESI-MS m/z 293 [M+Na]+,309 [M+K]+,315 [M+HCOO]-; 1H-NMR(CD3OD,600 MHz) δ:7.39(2H,d,J=6.4 Hz,H-2,6),7.34(2H,d,J=6.4 Hz,H-3,5),7.28(1H,d,J=6.4 Hz,H-4),4.83(1H,d,J=12.1 Hz,H-7α),4.58(1H,d,J=12.1 Hz,H-7β),4.23(1H,d,J=7.3 Hz,H-1′),3.03~3.09(4H,m,H-2′~5′),3.70(1H,d,J=11.3 Hz,H-6′α),3.53(1H,dd,J=11.2,5.3 Hz,H-6′β); 13C-NMR(CD3OD,150 MHz) δ: 138.5(C-1),128.1(C-2,6),128.6(C-3,5),127.8(C-4),70.6(C-7),102.5(C-1′),74.0(C-2′),77.4(C-3′),70.6(C-4′),77.2(C-5′),61.6(C-6′)。以上数据与文献[8]报道的benzyl O-β-D-glucopyranoside数据一致。 化合物6 白色粉末;ESI-MS m/z 279 [M+Na]+,255 [M-H]-; 1H-NMR(D2O,600 MHz) δ: 7.08(2H,d,J=7.8 Hz,H-2′,6′),6.75(2H,d,J=7.8 Hz,H-3′,5′),4.59(1H,s,H-3),3.03(1H,d,J=13.8 Hz,H-5α),3.00(1H,d,J=13.8 Hz,H-5β); 13C-NMR(D2O,150 MHz) δ: 176.0(C-1),174.6(C-4),154.4(C-4′),131.6(C-2′,6′),128.8(C-1′),115.1(C-3′,5′),80.7(C-2),75.1(C-3),40.4(C-5)。以上数据与文献[9]报道番石榴酸的数据一致。
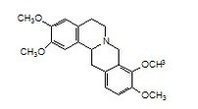
化合物7 白色结晶;ESI-MS m/z 469 [M+Na]+,485 [M+K]+,481 [M+Cl]-; 与三叶豆紫檀苷对照品共薄层对照,3个不同展开系统均为单一斑点,且与三叶豆紫檀苷对照品Rf一致;HPLC检查纯度和保留时间,与三叶豆紫檀苷保留时间一致。
化合物8 黄色粉末;ESI-MS m/z 899 [2M+Na]+,461 [M+Na]+,439 [M+H]+,437 [M-H]-; 1H-NMR(acetone-d6,600 MHz) δ: 7.40(1H,d,J=7.8 Hz,H-6′),6.48(1H,d,J=1.7 Hz,H-3′),6.47(1H,dd,J=1.7,7.8 Hz,H-5′),6.20(1H,s,H-6),5.62(1H,d,J=13.2 Hz,H-2),5.00(1H,s,H-4″),4.57(1H,s,H-9″α),4.56(1H,s,H-9″β),3.75(3H,s,-OCH3),2.86(1H,dd,J=13.2,17.0 Hz,H-3α),2.67(1H,d,J=17.0 Hz,H-3β),2.67(2H,m,H-1″),2.57(1H,m,H-2″),2.06(2H,m,H-3″),1.49(3H,s,H-6″),1.58(3H,s,H-7″),1.66(3H,s,H-10″),9.09(1H,s,7-OH),8.56(1H,s,2′-OH),8.31(1H,s,4′-OH); 13C-NMR(acetone-d6,150 MHz) δ: 74.2(C-2),44.8(C-3),188.5(C-4),161.5(C-5),92.6(C-6),163.0(C-7),107.6(C-8),160.3(C-9),106.8(C-10),117.5(C-1′),155.1(C-2′),105.3(C-3′),158.3(C-4′),106.9(C-5′),127.5(C-6′),27.2(C-1″),46.9(C-2″),31.0(C-3″),123.7(C-4″),130.7(C-5″),24.9(C-6″),17.0(C-7″),148.4(C-8″),110.2(C-9″),18.3(C-10″),54.9(-OCH3)。以上数据与文献[10]报道苦参酮一致。
化合物9 无色块状结晶;ESI-MS m/z 511 [M+Na]+,487 [M-H]-,523 [M+Cl]-; 1H-NMR(acetone-d6,600 MHz) δ: 7.41(1H,d,J=8.4 Hz,H-1),6.76(1H,dd,J=2.4,8.4 Hz,H-2),6.63(1H,d,J=2.4 Hz,H-4),6.91(1H,s,H-7),6.41(1H,s,H-10),5.93(2H,d,J=16.8 Hz,-OCH2O-),4.33(1H,dd,J=10.2,4.2 Hz,H-6β),3.67(1H,m,H-6α),3.63(1H,m,H-6a),5.54(1H,d,J=7.2 Hz,H-11a),4.98(1H,d,J=7.2 Hz,H-1′),3.49(1H,m,H-2′),3.76(1H,m,H-3′),3.42(1H,m,H-4′),3.55(1H,m,H-5′),4.42(1H,d,J=12.3 Hz,H-6′α),4.22(1H,dd,J=7.2,12.3 Hz,H-6′β),2.02(3H,s,-CH3); 13C-NMR(acetone-d6,150 MHz) δ: 131.8(C-1),110.6(C-2),158.9(C-3),104.5(C-4),156.6(C-4a),66.2(C-6),40.2(C-6a),118.4(C-6b),105.0(C-7),141.7(C-8),148.1(C-9),93.1(C-10),154.3(C-10a),78.2(C-11a),114.5(C-11b),101.2(-OCH2O-),100.7(C-1′),73.7(C-2′),74.1(C-3′),70.4(C-4′),76.9(C-5′),63.4(C-6′),170.0(CO),19.8(-OCH3)。以上数据与文献[11]报道三叶豆紫檀苷-6′-单乙酸酯数据一致。
化合物10 白色粉末;ESI-MS m/z 463 [M+K]+,447 [M+Na]+,425 [M+H]+,423 [M-H]-; 与槐属二氢黄酮G对照品共薄层对照,3个不同展开剂系统均为单一斑点,且与槐属二氢黄酮G对照品Rf一致;HPLC检查纯度为单一色谱峰,乙腈-0.2%磷酸水溶液(90∶10)系统下,与槐属二氢黄酮G对照品保留时间和在线紫外吸收一致。
化合物11 白色粉末;ESI-MS m/z 731 [2M+Na]+,355 [M+H]+,353 [M-H]-,707 [2M-H]-; 与异腐醇对照品共薄层对照,3个不同展开剂系统均为单一斑点,并且与异腐醇对照品Rf一致;HPLC检查纯度为单一色谱峰,乙腈-0.2%磷酸水溶液(90∶10) 流动相系统下,与异腐醇对照品保留时间和在线紫外吸收一致。 化合物12 白色粉末;ESI-MS m/z 377[M+Na]+,393[M+K]+,353 [M-H]-; 1H-NMR(acetone-d6,600 MHz) δ : 12.11(1H,s,5-OH),9.59(1H,s,3-OH),9.00(1H,s,7-OH),7.98(1H,s,4′-OH),8.19(2H,d,J=8.4 Hz,H-2′,6′),7.05(2H,d,J=8.4 Hz,H-3′,5′),6.37(1H,s,H-6),5.30(1H,t, J = 6.6 Hz,H-2″),3.58(2H,d,J=6.6 Hz,H-1″),1.83(3H,s,H-5″),1.68(3H,s,H-4″); 13C-NMR(acetone-d6,150 MHz) δ: 146.1(C-2),135.6(C-3),175.9(C-4),159.2(C-5),97.9(C-6),163.0(C-8),106.3(C-8),154.2(C-9),103.3(C-10),122.7(C-1′),129.6(C-2′,6′),115.5(C-3′,5′),159.3(C-4′),21.3(C-1″),122.6(C-2″),131.2(C-3″),24.9(C-4″),17.2(C-5″)。以上数据与文献[12]报道降脱水淫羊藿素的数据一致。
化合物13 白色粉末;ESI-MS m/z 1 147[2M+Na]+,585 [M+Na]+,563 [M+H]+,1 123 [2M-H]-,561[M-H]-; 1H-NMR(CD3OD,600 MHz) δ: 8.26(1H,s,H-2),8.16(1H,d,J=9.0 Hz,H-5),7.22(1H,dd,J=9.2,2.4 Hz,H-6),7.30(1H,d,J=2.4 Hz,H-8),7.50(2H,d,J=7.2 Hz,H-2′,6′),7.01(2H,d,J=7.2 Hz,H-3′,5′),5.06(1H,d,J=7.8 Hz,H-1″),4.05(1H,d,J=9.6 Hz,H-2″),3.97(1H,d,J=2.4 Hz,H-3″),3.36(1H,m,H-4″),3.72(1H,m,H-5″),4.08(1H,dd,J=10.8,1.8 Hz,H-6″α),3.66(1H,d,J=10.8 Hz,H-6″β),4.99(1H,d,J=2.4 Hz,H-1),3.52(1H,m,H-2),3.66(1H,m,H-3),3.78(1H,d,J=9.6 Hz,H-4),3.62(2H,d,J=9.0 Hz,H-5),3.84(3H,s,-OCH3); 13C-NMR(CD3OD,150 MHz) δ: 153.9(C-2),124.5(C-3),176.6(C-4),126.9(C-5),115.8(C-6),162.1(C-7),103.7(C-8),157.8(C-9),118.8(C-10),124.0(C-1′),130.0(C-2′,6′),159.8(C-4′),113.5(C-3′,5′),100.5(C-1″),73.3(C-2″),76.7(C-3″),70.3(C-4″),75.9(C-5″),67.7(C-6″),109.8(C-1),76.5(C-2),79.0(C-3),73.6(C-4),64.2(C-5),54.3(-OCH3)。以上数据与文献[13]报道4′-甲氧基异黄酮-7-O-β-D-芹糖-(1→6)-β-D-吡喃葡萄糖苷的数据一致。
化合物14 白色粉末;ESI-MS m/z 1 147[2M+Na]+,585[M+Na]+,563 [M+H]+,1 123 [2M-H]-,561 [M-H]-; 1H-NMR(CD3OD,600 MHz) δ: 8.28(1H,s,H-2),8.16(1H,d,J=9.0 Hz,H-5),7.25(1H,dd,J=9.0,2.4 Hz,H-6),7.38(1H,d,J=2.4 Hz,H-8),7.51(2H,d,J=1.8,6.6 Hz,H-2′,6′),7.01(2H,d,J=1.8,6.6 Hz,H-3′,5′),3.84(3H,s,-OCH3),5.06(1H,d,J=7.2 Hz,H-1″),4.14(1H,d,J=9.6 Hz,H-6″α),3.90(1H,dd,J=12.0,4.8 Hz,H-6″β),4.35(1H,d,J=7.2 Hz,H-1),3.81(1H,d,J=11.5,5.4 Hz,H-5α),3.17(1H,d,J=11.5 Hz,H-5β); 13C-NMR(CD3OD,150 MHz) δ: 153.9(C-2),124.0(C-3),176.6(C-4),126.9(C-5),115.8(C-6),162.0(C-7),103.7(C-8),157.9(C-9),118.8(C-10),124.5(C-1′),130.0(C-2′,6′),159.8(C-4′),113.5(C-3′,5′),100.4(C-1″),73.3(C-2″),76.5(C-3″),69.7(C-4″),76.0(C-5″),69.2(C-6″),104.4(C-1),73.7(C-2),76.3(C-3),70.3(C-4),65.5(C-5),54.3(-OCH3)。以上数据与文献[14]报道Kushenol O,即4′-甲氧基异黄酮-7-O-β-D-木糖-(1→6)-β-D-葡萄糖苷的数据一致。
化合物15 白色粉末;ESI-MS m/z 565 [M+H]+,599 [M+Cl]-;1H-NMR(DMSO-d6,600 MHz) δ: 12.92(1H,s,5-OH),9.61(1H,s,4″-OH),8.40(1H,s,H-2),7.40(2H,d,J=8.4 Hz,H-2′,6′),6.83(2H,d,J=8.4 Hz,H-3′,5′),6.77(1H,d,J=1.8 Hz,H-8),6.48(1H,d,J=1.8 Hz,H-6),5.03(1H,d,J=7.2 Hz,H-1″),3.29(1H,t,J=7.2 Hz,H-2″),3.64(1H,m,H-3″),3.20(1H,m,H-4″),3.27(1H,m,H-5″),3.92(1H,d,J=10.8 Hz,H-6″α),3.63(1H,d,J=10.8 Hz,H-6″β),4.17(1H,d,J=7.2 Hz,H-1),2.97(1H,t,J=7.2 Hz,H-2),3.30(1H,m,H-3),3.28(1H,m,H-4),3.69(1H,dd,J=11.3,5.3 Hz,H-5α),2.98(1H,t,J=11.3 Hz,H-5β);13C-NMR(DMSO-d6,150 MHz) δ : 155.1(C-2),123.1(C-3),181.1(C-4),162.1(C-5),99.7(C-6),163.4(C-7),95.0(C-8),157.8(C-9),109.9( C-10),121.5(C-1′),130.6(C-2′,6′),115.6(C-3′,C-5′),160.0(C-4′),100.8(C-1″),73.5(C-2″),76.5(C-3″),70.1(C-4″),77.0(C-5″),68.6(C-6″),104.3(C-1),73.9(C-2),77.0(C-3),69.9(C-4),66.1(5)。以上数据与文献[15]报道的6″-木糖-染料木素葡萄糖苷的数据一致。 [参考文献]
[1] 中国科学院中国植物志编委会. 中国植物志. 第40卷. 第1册[M]. 北京: 科学出版社, 1994: 81.
[2] 中国药典. 一部[S]. 2010: 187.
[3] 苗抗立,张建中,董颖,等. 苦参化学成分及药理的研究进展[J].天然产物研究与开发, 2000,13(2): 69.
[4] Calis I, Kuruuzum-Uz A, Lorenzetto P A, et al.(6S)-hydroxy-3-oxo-α-ionol glucosides from Capparis spinosa fruits [J]. Phytochemistry, 2002, 59: 451.
[5] 吴立军,沈燕,郑健, 等. 丁香苷的核磁共振研究[J]. 波谱学杂志, 1999, 16(5): 465.
[6] 史雪凤, 唐旭利, 李国强, 等. 中国南海高领类尖柳珊瑚Muriceides collaris 化学成分研究[J]. 中国海洋药物杂志, 2009, 28(2): 18.
[7] Sano K, Sanada S, Ida Y, et al. Studies on the constituents of the bark of Kalopanax pictus Nakai[J]. Chem Pharm Bull, 1991, 39(4): 865.
[8] Marino S D, Festa C, Franco Z, et al. Phenolic glycosides from Cucumis melo var. inodorus seeds [J]. Phytochem Lett, 2009, 2: 130.
[9] Toshima H, Saito M, Yoshihara T. Total synthesis of (+)-(2S, 3R)-piscidic acid via catalytic asymmetric dihydroxylation of a trisubstituted olefin[J]. Biosci Biotechnol Biochem, 1999, 63(5): 964.
[10] Hatayama K, Komatsu M. Studies on the constituents of Sophora species.V. Constituents of the root of Sophora angustifolia Sieb. Et Zucc.(2) [J]. Chem Pharm Bull, 1971, 19: 2126.
[11] 李丹,左海军,高慧援,等. 苦参化学成分[J]. 沈阳药科大学学报, 2004, 21(5): 346.
[12] 林定威. 苦参根部化学成分分析[D]. 中坜:中原大学, 2006.
[13] Jun C, Zhao Y Y, Wang B. Flavonoids from Milletianitida var. hirsu tissima[J]. Chem Pharm Bull, 2005, 53:419.
[14] 黎雄, 李剑芳, 王东, 等. 怀槐树皮异黄酮苷类化学成分研究[J]. 药学学报, 2009, 44(1): 63.
[15] 徐德平,肖凯,谷文英,等. 大豆胚芽中新异黄酮化合物的研究[J]. 中草药,2003, 12: 1065.
Non-alkaloid components from Sophora flavescens
ZHANG Chi1,2,3, MA Yue1,2, GAO Hui-min1,2*, LIU Xiao-qian1,2, CHEN Liang-mian1,2,
ZHANG Qi-wei1,2, WANG Zhi-min1,2*, LI An-ping4
(1.Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
2. National Engineering Laboratory for Quality Control Technology of Chinese Herbal Medicines, Beijing 100700, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
4. Shanxi Zhendong Pharmaceutical Limited Company, Changzhi 047100, China)
[Abstract] Five compounds were obtained from the stems and leaves of Sophora flavescens Ait. and ten compounds were obtained from the roots of S.flavescens by various chromatography methods including silica gel column chromatography and preparative HPLC. Their structures were identified on the basis of spectroscopic methods including 1H-NMR,13C-NMR and ESI-MS, as corchionoside C(1), syringing(2), 2′-deoxythymidin(3), coniferin(4), benzyl O-β-D-glucopyranoside(5), piscidic acid(6), trifolirhizin(7), kurarinone(8), trifolirhizin-6′-monoacetate(9), sophoraflavanone G(10), isoxanthohumol(11), noranhydroicaritin(12), 4′-methoxyisoflavone-7-O-β-D-apiofuranosyl-(1→6)-β-D-glucopyranoside(13), kushenol O(14) and 6″-β-D-xylopyranosylgenistin(15). Compounds 1-6 were isolated from the Sophora genus for the first time.
[Key words] Sophora; Sophora flavescens; isoflavone
doi:10.4268/cjcmm20132022
百度搜索“爱华网”,专业资料、生活学习,尽在爱华网!
 爱华网
爱华网