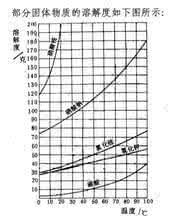
溶解度
solubility
在一定的温度和压力下,物质在一定量的溶剂中达到溶解平衡时的最高量。通常以100克溶剂中所能溶解的物质的克数表示。影响溶解度的因素很多,主要有:①溶剂和溶质本身的性质。如水和乙醇可以无限制地相互混溶;乙醇和煤油可以有限地混溶;水和煤油之间则几乎不相互溶解。对上述现象的解释乃是:水分子式是HOH,乙醇是CH3CH2OH,它们的分子中都有-OH ,而且分子大小比较接近,因此两者可以互相混溶。煤油的分子式是 CH3(CH2)nCH3(n为8~16),煤油和乙醇分子中都有—CH3和,但它们分子的大小相差较大,只能有限地混溶。水分子的结构与煤油毫无相似之处,所以煤油几乎完全不溶于水。这一经验规律可概括为“相似者相溶”。另外,溶剂和溶质之间能形成氢键时,也会使溶解度增大。②温度的影响。可分3种情况,第一,溶质( 如硝酸钾)在水中的溶解度随温度的升高增加很大;第二,溶质(如氯化钠)在水中的溶解度随温度的升高增加很小;第三,溶质(如硫酸钙)在水中的溶解度随温度的升高反而降低。③压力的影响。主要是对气体溶质在液体中的溶解度影响显著。压力增大,气体的溶解度总是增大的。如果压力不太大,则气体的溶解度与压力成正比,上述结论称为亨利定律。以上就是网友分享的关于"溶解度"的相关资料,希望对您有所帮助,感谢您对爱华网的支持!
爱华网本文地址 » http://www.aihuau.com/a/344251/374544958877.html
更多阅读
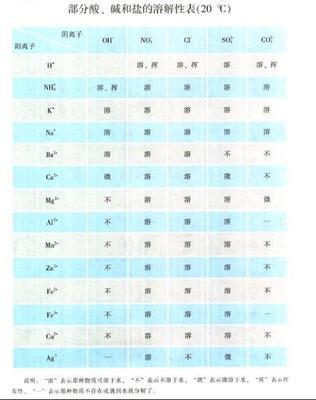
溶解度表以化学品中特征元素的拼音顺序排列。所有数据都为1atm下的数据,单位为g/100cm3。内容列表: 锕、氨、铵、钯、钡、铋、铂、钚、氮、镝、铒、钒、钆、钙、锆、镉、铬、汞、钴、硅、铪、氦、钬、镓、钾、金、钪、镧、锂、硫、镥
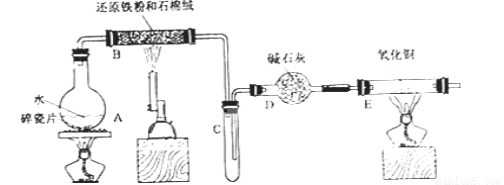
Fe(OH)3在水中溶解度的计算在基本化学理论教学中,对化学平衡理论把握不准确是个较普遍的现象。像Fe(OH)3在水中溶解度的计算就是一个很典型的例子。当在一些相当权威且有影响的教
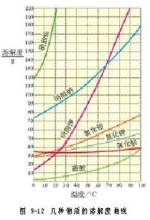
一、定义:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。二、计算公式有关溶解度的计算公式(溶质为不含结晶水的固体)
牛磺酸(Taurine)又称β-氨基乙磺酸,最早由牛黄中分离出来,故得名。纯品为无色或白色斜状晶体,无臭,牛磺酸化学性质稳定,不溶于乙醚等有机溶剂,是一种含硫的非蛋白氨基酸,在体内以游离状态存在,不参与体内蛋白的生物合成。牛磺酸虽然不参与蛋白
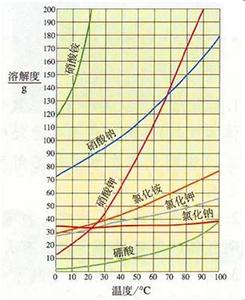
溶解度,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。在这里要注意:如果没有指明溶剂,通常所说的溶解度就是物质在水里的溶解度。溶解度的单位是克(或者是克/100克溶剂)而不是没有

 爱华网
爱华网



