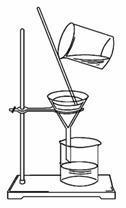
皿中液体不宜多,
防止飞溅要搅动。
较多固体析出时,
移去酒灯自然蒸。
解释:
1、皿中液体不宜多,防止飞溅要搅动:“皿”指蒸发皿。意思是说加入蒸发皿中的液体不宜过多(一般不应超过蒸发皿容积的2/3),在加热过程中,要用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。
2、较多固体析出时,移去酒灯自然蒸:意思是说当蒸发皿中出现较多的固体时,应立即停止加热,利用蒸发皿的余热使液体自然蒸干。
【典型例题】
1、“粗盐提纯”的实验中,蒸发时,下列操作正确的是( )
A.把还浑浊的滤液倒入蒸发皿里加热蒸发
B.开始析出晶体后,要用玻璃棒不断搅拌液体
C.蒸发皿中出现多量固体时,就停止加热
D.待滤液完全蒸干时,才停止加热
【考点】氯化钠与粗盐提纯;实验操作注意事项的探究
【解析】A、把还浑浊的滤液倒入蒸发皿里加热蒸发,操作错误;B、开始析出晶体后,要用玻璃棒不断搅拌液体,操作错误;C、蒸发皿中出现多量固体时,就停止加热,操作正确;
D、待滤液完全蒸干时,才停止加热,操作错误;故选C。
【答案】C
【点评】本题主要考查物质的粗盐的提纯和净化问题,掌握混合物的一些分离方法,还考查了一些实验操作的注意事项。
2、下列实验不能按照蒸发、浓缩、结晶、过滤操作程序进行的是( )
A.从FeSO4溶液中得到绿矾[FeSO4·7H2O]晶体
B.从MgCl2溶液得到MgCl2·6H2O晶体
C.从含硝酸钠和氯化钾物质的量浓度基本相等的混合溶液中分离出氯化钠
D.从饱和食盐水中得到蒸馏水
【考点】物质的分离、提纯的基本方法选择与应用
【解析】A.FeSO4溶液经蒸发、浓缩、结晶后析出[FeSO4·7H2O]晶体,过滤后可得晶体,注意防止硫酸亚铁被氧化,故A不选;B.MgCl2溶液经蒸发、浓缩、结晶、过滤可的MgCl2·6H2O晶体,注意要防止氯化镁的水解,应在盐酸氛围中蒸发,故B不选;C.由于氯化钠的溶解度随温度变化不大,可经蒸发、浓缩、结晶、过滤操作从含硝酸钠和氯化钾物质的量浓度基本相等的混合溶液中分离出氯化钠,故C不选;D.从饱和食盐水中得到蒸馏水,应用蒸馏的方法,故D选。故选D。
【答案】D
【点评】本题考查物质的分离、提纯等基本实验的操作,综合考查学生的实验能力和分析能力,易错点为C,注意氯化钠溶解性的特点,题目难度不大。
3、蒸发时,下列操作不正确的是( )
A.开始析出晶体后,要用玻璃棒搅拌液体
B.向蒸发皿中注入液体量不超过其容积的2/3
C.等液体完全蒸干,才停止加热
D.蒸发皿中出现较多量固体时停止加热
【考点】蒸发与蒸馏操作
【解析】A、蒸发时要用玻璃棒不断搅拌防止受热不均造成液滴飞溅,A正确;B、蒸发皿中注入液体量不超过其容积的1/3,B正确;C、不能等液体蒸干才停止加热,只要蒸发皿中出现较多的固体就停止加热,C不正确;D、蒸发皿中出现较多的固体就停止加热,利用余热将剩余的液体蒸干,D正确;故选C。
【答案】C
【点评】蒸发操作的过程中,切记不可加热到无液体剩余时再停止加热,防止将蒸发皿烧裂。
4、(2012·嘉定区二模)实验室提纯含有少量生石灰、泥沙的NaCl固体,进行如下提纯实验:
回答下列问题:
①操作甲的名称是 ;溶液A中所含溶质为 (填化学式)
②加入Na2CO3溶液所发生反应的化学方程式为
③加入的过量X溶液作用是
④以下关于蒸发的操作正确的是
Ⅰ.蒸发皿必须放在石棉网上加热 Ⅱ.蒸发完成后立即用手移去蒸发皿
Ⅲ.加热蒸发时不断用玻璃棒搅拌 Ⅳ.蒸发时待水分全部蒸干后停止加热
【考点】混合物的分离方法;蒸发与蒸馏操作;生石灰的性质与用途;盐的化学性质
【解析】①由图示知,操作甲是把不溶物与溶液分离,是过滤操作;生石灰与水反应生成氢氧化钙,所以溶液A中所含溶质为Ca(OH)2、NaCl,故填:过滤;Ca(OH)2、NaCl;②碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;③由题意知,加入的X是稀盐酸溶液,目的是除尽B溶液中的氢氧化钠和碳酸钠,故填:除尽B溶液中的氢氧化钠和碳酸钠;④Ⅰ.蒸发皿可以直接加热,不须放在石棉网上加热,该说法错误;Ⅱ.蒸发完成后,还有大量的余热,不能立即用手移去蒸发皿,该说法错误;Ⅲ.加热蒸发时不断用玻璃棒搅拌,防止局部受热沸腾溅出,该说法正确;Ⅳ.蒸发时待大量晶体析出时,停止加热,利用蒸发皿的余热把剩余的水蒸干,该说法错误;故选Ⅲ。
【答案】①过滤 ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH ③除尽B溶液中的氢氧化钠和碳酸钠 ④Ⅲ
【点评】在解此类题时,首先分析题中考查的问题,然后结合具体的反应流程和学过的知识进行分析解答。
 爱华网
爱华网