如图甲为用氢气还原氧化铜的微型快速实验装置,实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的小匙,将铜丝2一段弯曲成螺旋状,试回答下列问题:
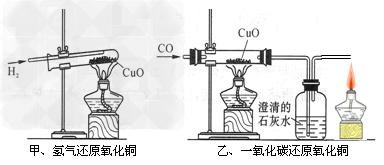
(1)在图甲的试管I中先加入的试剂是
试题答案
考点:性质实验方案的设计,铜金属及其重要化合物的主要性质 专题: 分析:(1)金属锌可以和盐酸或是稀硫酸反应生成氢气;(2)铜丝在酒精灯上加热至红热,可以得到氧化铜;(3)金属锌可以和酸反应产生氢气,氢气还原氧化铜得到金属铜和水;(4)金属铜、锌、硫酸可以形成原电池,加快反应速率,根据影响化学反应速率的因素来回答;(5)乙醇和氧化铜在加热下发生反应生成金属铜和乙醛. 解答: 解:(1)金属锌可以和盐酸或是稀硫酸反应生成氢气,图甲的试管I中先加入的试剂是盐酸或稀硫酸,故答案为:盐酸或稀硫酸;(2)铜丝在酒精灯上加热至红热,可以得到氧化铜,在Ⅰ中开始产生H2后,将铜丝2在酒精灯上加热至红热,迅速伸入到Ⅱ中,即可引发氢气和氧化铜之间的反应,故答案为:在Ⅰ中开始产生H2后,将铜丝2在酒精灯上加热至红热,迅速伸入到Ⅱ中;(3)金属锌可以和酸反应产生氢气,现象是:锌粒不断溶解,有气泡产生;氢气还原氧化铜得到金属铜和水,现象是:红热铜丝由黑色变为红色,故答案为:锌粒不断溶解,有气泡产生;红热铜丝由黑色变为红色;(4)处理铜丝1目的是让铜丝1和锌形成原电池,产生氢气速率加快,实验完毕可将铜丝提起,反应随即停止,铜丝2弯曲成螺旋状是为了增大接触面积,提高铜丝局部的温度,以利于CuO在H2中持续、快速被还原,故答案为:铜丝1和锌形成原电池,产生氢气速率加快,实验完毕可将铜丝提起,反应随即停止;铜丝2弯曲成螺旋状是为了增大接触面积,提高铜丝局部的温度,以利于CuO在H2中持续、快速被还原;(5)乙醇和氧化铜在加热下发生反应生成金属铜和乙醛,使得铜丝由黑变红,故答案为:乙醇. 点评:该题综合了氢气还原氧化铜和乙醇催化氧化两个实验,还原氧化铜的实验关键是温度的保持,绕成螺旋状显然是为了保持较高的温度.
 爱华网
爱华网