DMF简介
一、 定义
DMF: Drug Master File, 译为“药品主文件”,或者“药品管理档案”。
它是由原料供应商提交给FDA(食品药品监督管理局)的一份保密文件, 包括药品生产,加工,包装和储存过程中的使用的设备,工艺和材料的详细信息。
DMF应该以英语撰写,申报文书中包括其他语种时,必须包括准确的英文翻译。

二、 背景
根据美国的“食品、药品和化妆品法”,药品(制剂)在上市之前,必需要向FDA提出新药注册申请,提供拟上市新药及其成分在“安全性、有效性和质量”三方面的全部信息,FDA做出全面评价认为满足要求后,才能给与批准上市。
当制剂生产商使用的原料成分不是自己生产的,就需要其供应商提供有关原料成分的所要求的各种信息供FDA评审使用。但原料成分供应生产商一般不愿意将自己产品的有关信息透露给非官方的第三方。为了解决这一问题,FDA建立了DMF程序,允许在原料成分的供应商不愿意将自己产品的有关信息透露给非官方的第三方时,制剂生产商注册需要的有关信息,可由原料成分的供应商自己以DMF文件的形式直接提交给FDA,以支持药品申请的审评。
三、 分类
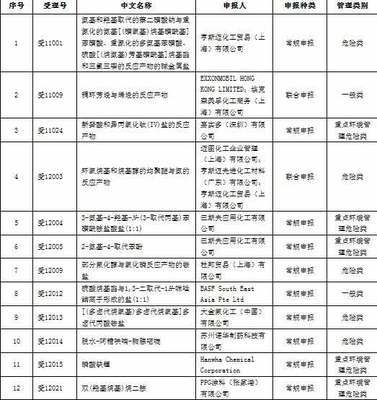
在FDA发布的《DMF指南》中,DMF分为以下五个类型
I型,生产地点、厂房设施、操作步骤和人员;(2000年7月12日已取消)
II型,原料药、原料药中间体、生产前述物质使用的原材料,或药品;
III型,包装物料;
IV型,赋形剂、着色剂、香料、香精,或生产这些物质的原材料;
V型,FDA一般认可的参考信息
第 1 页 meitek,change your life!
 爱华网
爱华网