基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
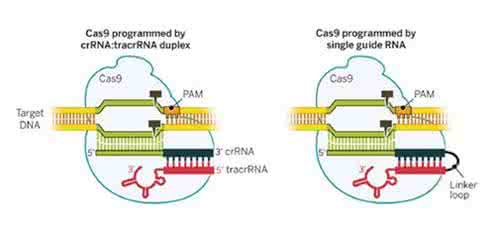
在CRISPR/Cas9系统中,酶Cas9在DNA靶位点上进行切割,其中这种靶位点是这样确定的:一种被称作CRISPR RNA(crRNA)的RNA分子利用它的一部分序列与另一种被称作tracrRNA的RNA分子通过碱基配对结合在一起,形成嵌合RNA(tracrRNA/crRNA),然后,借助crRNA的另一部分序列与靶DNA位点进行碱基配对,以这种方式,这种嵌合RNA就能够引导Cas9结合到这个靶位点上并进行切割。在实际应用时,人们可以将tracrRNA和crRNA作为两种向导RNA(gRNA)或者融合在一起形成单向导RNA(single guide RNA, sgRNA),并被用来引导酶Cas9结合到靶DNA序列上并进行切割,其中Cas9与sgRNA一起被称作Cas9-sgRNA系统。
进一步的研究还证实,CRISPR/Cas9的基因组编辑能力只有在被称作前间隔序列邻近基序(protospacer adjacent motif, PAM)的短片段DNA序列的存在下才成为可能。只有DNA靶位点附近存在PAM时,Cas9才能进行准确切割。再者,PAM的存在也是激活酶Cas9所必需的。
尽管科学家们已采用多种方式对CRISPR/Cas9系统进行优化来提高它的效率和特异性,它仍然存在一些不足之处,如CRISPR/Cas9系统仍然会在脱靶位点(在这些位点上,gRNA与靶DNA序列之间存在错配)进行切割,这种脱靶切割有可能导致很多有害的后果,如癌症产生;gRNA容易形成二级结构,等等。
在一项新的研究中,来自中国河北科技大学和浙江大学医学院的研究人员发现类似于Cas9,来自Argonaute蛋白家族的核酸内切酶也利用寡核苷酸作为向导降解入侵的基因组。具体而言,他们发现来自格氏嗜盐碱杆菌(Natronobacterium gregoryi)的一种Argonaute蛋白(NgAgo)作为一种核酸内切酶,在向导DNA(guide DNA, gDNA)的引导下,能够在人细胞中进行基因组编辑。相关研究结果于2016年5月2日在线发表在Nature Biotechnology期刊上,论文标题为“DNA-guided genome editing using the Natronobacterium gregoryi Argonaute”。论文通信作者为河北科技大学生物科学与工程学院韩春雨(Chunyu Han)副教授。
来自格氏嗜盐碱杆菌的Argonaute蛋白利用单链gDNA切割靶DNA
尽管来自嗜热栖热菌(Thermus thermophilus)的Argonaute蛋白(TtAgo)或来自强烈炽热球菌(Pyrococcus furiosus)的Argonaute蛋白(PfAgo)在5’端发生磷酸化的单链DNA存在下能够在体外切割DNA靶序列,但是它们都需要非常高的反应温度(>65 °C),这就使得它们不能够应用于哺乳动物细胞中。为了解决这一问题,研究人员利用PSI-BLAST搜索工具以TtAgo和PfAgo氨基酸序列为对象,在美国国家生物技术信息中心(NCBI)非冗余蛋白序列数据库中进行搜索,从中鉴定出一种潜在的候选蛋白:来自格氏嗜盐碱杆菌SP2菌株的Argonaute蛋白(即NgAgo)。
研究人员接着设计三种5’端发生磷酸化的长24个核苷酸的单链gDNA,其中两种单链gDNA彼此互补(记为FW和RV),而且能够结合到pACYCDuet-eGFP质粒的靶位点上;第三种单链gDNA含有随机的碱基序列,但不与这种质粒互补(记为NC)。此外,他们还设计了一对5’端发生磷酸化的单链gRNA,它们也能够结合这种相同的靶位点上。结果证实,在没有gDNA存在时,或者在NC gDNA存在时,NgAgo都不能切割这种质粒。当FW或RV gDNA存在时,NgAgo能够在37 °C下让这种超螺旋的质粒产生切口。当FW和RV gDNA同时存在时,NgAgo能够让这种质粒线性化。但是,在5’端未发生磷酸化的单链gDNA或者5’端发生磷酸化的单链gRNA存在下,NgAgo都不能切割这种质粒。
因此,NgAgo当与5’端发生磷酸化的单链gDNA结合时能够在37 °C下切割靶双链DNA。
NgAgo结合单链gDNA,并导致靶DNA发生双链断裂
为了评估NgAgo是否能够作为一种基因组编辑工具进行使用,研究人员首先在293T细胞中表达NgAgo,并研究它是否与人细胞中的内源性核酸结合,结果他们并未检测到与从293T细胞中纯化出来的NgAgo相结合的核酸,这提示着人细胞中存在的5’端发生磷酸化的单链DNA是非常少的,而且即便存在内源性的单链DNA,也不会将NgAgo引导到脱靶位点上。
研究人员利用编码NgAgo的质粒和这些人工合成的长24个核苷酸的单链gDNA或gRNA(5’端发生或未发生磷酸化)转染293T细胞时,发现NgAgo只能结合5’端发生磷酸化的单链gDNA,而不能结合单链gRNA和5’端未发生磷酸化的单链gDNA。
当将编码NgAgo的质粒转染到293T细胞24小时后再将5’端磷酸化的单链gDNA运送到这些细胞中时,研究人员发现NgAgo结合单链gDNA的数量显著下降,这提示着当NgAgo表达时,它只有在较短的时间内装载单链(或者说结合)gDNA。与这相一致的是,当从293T细胞中纯化出来的未装载单链gDNA的NgAgo在37 °C下即便与单链gDNA在体外孵育长达8小时,单链gDNA也不会装载到NgAgo上。再者,单链gDNA在体外只能在比较高的温度(55 °C)下装载到NgAgo上。只有从已进行单链gDNA转染的293T细胞中纯化出来的NgAgo,而不是在37 °C下与单链gDNA(FW gDNA,或者RV gDNA)孵育的NgAgo,才能在体外切割靶DNA。
 爱华网
爱华网