原电池[教学设计]针对全日制普通中学人民教育出版社教科书化学第一册第4章第一节的内容,采用“提出问题――做出假设――设计方案――实验验证――得出结论――解释反思――表达交流”的流程完成教学过程的设计。
原电池教案_原电池[教学设计] -基本信息
科目:无机化学
教学对象:高一学生
课时:2教学环境:多媒体教室原电池教案_原电池[教学设计] -教材分析
学生在必修阶段已经初步学习了原电池的基本知识,选修阶段是提高阶段,教材第二节电解知识的学习也为学习原电池奠定了基础。原电池知识也具有十分重要的用价值――是研发化学电源和防止金属电化腐蚀的基础。并且可以强化氧化还原反应的有关知识。课标要求
体验化学能与电能相互转化的探究过程,了解原电池的工作原理,能写出电极反应和电池反应方程式。通过查阅资料了解常见化学电源的种类及其工作原理,认识化学能与电能相互转化的实际意义及其重要应用。
能解释金属发生电化腐蚀的原因,认识金属腐蚀的危害,通过实验探究防止金属腐蚀的措施。
原电池教案_原电池[教学设计] -教学目标
1、了解原电池是将化学能转化为电能的装置;认识化学能转化为电能的实际意义2、知道原电池中氧化和还原分别在两极进行,负极氧化正极还原,会结合实例分析原电池的工作原理。
3、会判断简单的原电池,会写出电极反应式和电池反应式
4、通过探究原电池的工作原理,提高解决问题能力和思维能力
教学重点:原电池的工作原理
难点:盐桥装置的理解
原电池教案_原电池[教学设计] -教学过程设计
教学程序教师活动
学生活动
设计意图
1、引入
电解过程可以把电能转化为化学能,那么反过来化学能能否转化为电能呢?
听、思
启发逆向思维
2原电池工作原理的探究
金属锌能否与硫酸铜溶液反应?如何用实验证明反应是吸热还是放热?
书写、思考
启发自发反应氧化还原反应,为电子的定向移动奠基
你能否写出反应的离子方程式?电子转移情况如何?
思考书写
启发使电子流动起来形成电流
你能否根据必修学过的知识使上述反应放出的能量不是以热而是以电能的形式放出?启发:得失电子不能在同一区域直接传递;两端要有电势差
听讲、思考
整合必修与选修的知识衔接、温故知新
请画出装置草图,并实施实验,记录现象
画图、实验、记录现象
巩固必修内容
什么叫原电池?原电池中如何确认正负极?电子流动方向?溶液中离子移动方向?正负极与阴阳极什么关系?铜电极材料反应吗?能换成什么材料?
讨论作答
分析原电池原理
如何书写上述装置的电极反应式?电池反应式?
书写、交流
总结归纳电极反应式书写规则
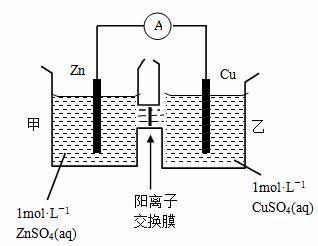
甲在北京需要钱,乙在郑州不去北京送钱能解决问题吗?锌片如果和硫酸铜溶液不接触能发生电子得失产生电流吗?思考
利用银行汇兑类比启发、引出双液电池
演示双液电池
观察现象
提升思维认识:不接触也能反应
为什么也产生电流?
盐桥的作用是什么?
能否写出电极反应式和电池反应式
思考、回答、书写
迁移反馈
能否把铜与硝酸银溶液的反应设计成原电池?画出草图,做必要标示,书写电极反应式和电池反应式
思考、画图、书写
巩固新知、提升认识
小结
布置作业
原电池教案_原电池[教学设计] -学习者特征分析
由于学生之前没有电化学的基础,理解原电池原理有一定的难度。原电池原理和组成条件是本节课的重点,原电池原理是本节课的难点。本节教材设置了大量的探究教学素材,让学生动手做实验并观察记录实验结果,富有深刻的探究教学思想内涵。
原电池教案_原电池[教学设计] -学习内容分析
把化学能转化为电能的装置叫原电池。
原电池的工作原理:原电池将氧化还原反应分开在两个电极上发生。还原剂所失去的电子通过导线流向另一电电极,氧化剂再从电极上得到电子而被还原。
原电池教案_原电池[教学设计] -《原电池》--教学目标分析
1、知识:使学生了解原电池装置,认识原电池的化学原理,形成原电池的条件,以及原电池中能量的转化关系。2、能力:培养和发展学生的观察能力,思维能力、自学能力和实验能力。
原电池教案_原电池[教学设计] -教学重点与难点
[教学重点]:原电池的化学原理。
[教学难点]:原电池的化学原理和构成原电池的条件
原电池教案_原电池[教学设计] -教学策略的选择
[教学方法]:实验探究法[教学用品]:投影仪、电流计、干电池、Cu片、Zn片、导线、烧怀、稀H2SO4小黑板等。
《原电池》--教学过程与媒体
课堂教学设计
[引入情境]:向学生展示干电池、畜电池、以及原电池装置等。
师:同学们这些都是什么东西?
生:电池。
师:今天我们就用实验来探究原电池的装置、原电池的化学原理、形成原电池的条件以及原电池中能量的转化等。
[板书]:原电池装置、原电池的化学原理、形成原电池的条件以及原电池的能量转化。
师:下面大家做实验1,并如实填写实验报告(投影)
学生实验探究一
编号实验操作现象结论
1、把Zn片插入稀H2SO4中
Zn片上是否有气泡产生
Zn与稀H2SO4反应
成什么气体
化学方程式:
离子方程式:
师:Zn与稀H2SO4反应生成了什么气体,是什么反应?电子转移的方向如何?
生:Zn与称H2SO4反应生成了H2,是氧化还原反应,电子是从Zn原子转移给H+。
师:我们知道,化学反应都伴随着能量的转化(如热能、光能、电能等),如果我们把Zn与稀H2SO4放入试管中反应,时间稍长,试管就发热,那么这个反应说明了什么?
生:热能,说明化学能转化成了热能。
师:对,回答得很好,下面我们来做实验2,并如实填写实验报告(投影)
学生实验探究二
编号实验操作现象结论
2、把Cu片插入稀H2SO4中
Cu片上有无气泡产生
说明Cu与稀H2SO4是否反应
师:为什么Cu与稀H2SO4不反应呢?
生:Cu不活泼,Cu的金属活动性排出(H)以后。
师:对大家分析得很好,下面我们来做实验了,并如实填写实验报告。(投影)
学生实验探究三
编号实验操作现象结论
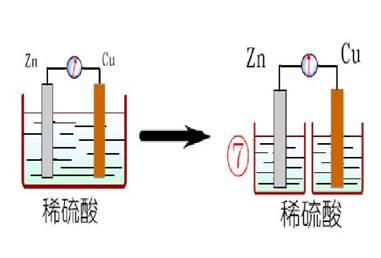
3、把Zn片和Cu片用导线连接后一齐插入稀H2SO4中
Cu片上有无泡产生Zn片上质量是否减少
Zn与溶解Cu片上有稀H2生成,电子是从
转移到上。Zn片的反应是,Cu极上的么应是
师:为什么Cu片上有气体成呢?这种气体是什么呢?Cu片是否参加反应呢?电子的转移又如何呢?能量的变化又是怎样的呢?等等引起学思考。
启发诱导学生思考并明确:Cu片上有气泡是H2,Cu并没有参加反应(从溶液中的颜色可以知道),从实验中观察到,Zn片不断在溶解。这说明了参加反应的金属是Zn。通过分析知道,电子是从Zn极经导线流向Cu极,Zn失去电子变成Zn2+进入溶液(发生了氧化反应),深液中的H+从Cu极上获得电子生成H2放出(发生了还原反应),两极的反应式是:
Zn极:Zn-Ze→Zn2+
Cu极:2H++2e→H2↑
总的离子反应式是:Zn+2H+=Zn2++H2↑
总的化学方程式是:Zn+H2SO4=ZnSO4+H2↑
师:既然电子是从Zn片经导线流向Cu片,那么导线中就应该有电流存在(为什么?),是否有电流存在呢?下面我们来做验4,并如实填写实验报告。(投影)
学生实验探究四
编号实验操作现象结论
4、在导线中间接上电流计再把Zn、Cu片插入稀H2SO4
指针是否
偏传
导线上是否有电流存在
在这个装置中化学能转变成了
师:现在我们也经证实了导线上确实有电流存在,说明了这个装置已经把化学能转化成了电能,这种装置就叫原电池。
[析书]:原电池―任何化学能转化成电能的装置,都叫原电池。
师:即然导线中有了电流,那么电流的方向如何呢?下面我们来做实验5,并如实填写实验报告(投影)
学生实验探究五
编号实验操作现象结论
5、①先用干电池判断电流的方向。(电流计指针偏转方向)②再用原电池判断电流的方向(指针偏转方向)
①干电池:电流计指针向
②原电池:电流计指针向
偏转。
原电池中:Zn是极,Cu是极。电子是从极流向极,
电流是从极流向极。
师:大家判断得很正确,这就是原电池的化学原理。
[板书]:原电池的化学原理:在原电池中,电子是从负极(较活泼的金属)经导线流向正极(较不活泼的金属或碳棒),电流是从正极流向负极,负极失去电子发生氧化反应;正极获得电子(常常是溶液中的H+或金属离子获得电子)发生了还原反应。这样通过氧化――还原反应形成了电流,实现了化学能转化成电能的过程。
师:是否任何金属、任何溶液都能形成原电池呢?下面让我们来做实险6,并如实填写实验报告:(投影)
学生实验探究六
编号实验操作现象结论
6、①用相同的Cu片或Zn片用导线连接好后插入稀H2SO4中;②把Zn片和Cu片用导线连接好后,插入酒精溶液中。
①电流计指针是否偏转
②电流计指针是否偏转
①有无电流产生
②有无电流产生
师:这说明了形成原电池是有条件的
原电池教案_原电池[教学设计] -学生实验报告
编号 实验操作 现象 结论
1、把Zn片插入稀H2SO4里
Zn片上有无气泡产生
Zn与稀H2SO4反应生成的气体
化学方程式离子方程式
2、把Cu片插入稀H2SO4里
Cu片上有无气泡产生
Cu与稀H2SO4是否反应
3、把Zn片和Cu片用导线连接好后一齐插入稀H2SO4中
Cu片上有无气体产生
Zn片质量是否减少
Zn与Cu谁活泼
电子是从铜流向Zn,还是从Zn流向Cu
4、在导线中间接上电流计然后把Zn和Cu一齐插入稀H2SO4中
电流计的指针是否偏转
导线上是否有电流产生
说明化学能转化成了什么能
5、①先用干电池确定电流的方向
②再用原电池判断电流的方向。
①干电池,指针向哪面偏转
②原电池,指针向哪面偏转
原电池中,Zn是原电池的正极还是负极
Cu是原电池的正极还是负极
电子是从Zn流向Cu还是从Cu流向Zn
电流是从Zn流向Cu还是从Cu流向Zn
6、①用两片Cu(或两片Zu)连接后插入接稀H2SO4中,
②用Zn片和Cu片连接好后插入稀酒精中
①电流计指针是否发生偏转
②电流计指针是否发生偏转
①有无电流产生
②有无电流产生
原电池教案_原电池[教学设计] -备注与反思
1、通过学生一系列的实验探究,更能提升学生对原电池原理的深刻认识。2、通过学生一系列的实验探究,更好地落实教学中的三维目标。
3、通过学生的一系列实验探究,使学生更好地体验探究知识的乐趣。
4、通过学生的一系列实验探究,能更好地培养学生探究科学的意识和能力。
5、通过学生一系列的实验探究,有利于学生好奇心的激发,学习动力的激发,更好地培养学生的学习兴趣。
原电池教案_原电池[教学设计] -相关说明
此教学设计任务由南京晓庄学院现代教育技术课程老师yqiong参与教师-维基星光计划进行wiki教学而发布。此词条为范例词条,由黄晨淳选定主题并负责、参与现代教育技术课程的所有同学协作共同完成!
 爱华网
爱华网