免疫球蛋白(immunoglobulin)指具有抗体活性的动物蛋白。主要存在于血浆中,也见于其他体液、组织和一些分泌液中。人血浆内的免疫球蛋白大多数存在于丙种球蛋白(γ-球蛋白)中。免疫球蛋白可以分为IgG、IgA、IgM、IgD、IgE五类。 由两条相同的轻链和两条相同的重链所组成,是一类重要的免疫效应分子;由高等动物免疫系统淋巴细胞产生的蛋白质,经抗原的诱导可以转化为抗体。因结构不同可分为IgG、IgA、IgM、IgD和IgE 5种,多数为丙种球蛋白。 可溶性免疫球蛋白存在于体液中,参与体液免疫;膜型免疫球蛋白是B淋巴细胞抗原受体。
免疫球蛋白_免疫球蛋白 -抗体与Ig
抗体是机体免疫细胞被抗原激活后,B细胞分化成熟为浆细胞后所合成、分泌的一类能与相应抗原特异性结合的具有免疫功能的球蛋白。抗体是生物学功能上的概念,而免疫球蛋白是化学结构上的概念。所有抗体的化学基础都是免疫球蛋白,但免疫球蛋白并不都具有抗体活性。
免疫球蛋白_免疫球蛋白 -主要结构
免疫球蛋白
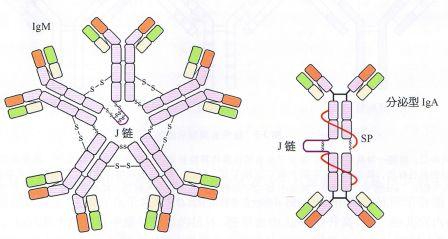
Ig 分子的基本结构是由四肽链组成的,即由二条相同的分子量较小的轻链(L 链)和二条相同的分子量较大的重链(H 链)组成的。L链与H链是由二硫键连接形成一个四肽链分子,称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。现已知5 种免疫球蛋白中IgG、IgA 和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2 和CH3)共四个功能区。IgM和IgE 的H链各有一个可变区(VH)和四个恒定区(CHl、CH2、CH3 和CH4)共五个功能区。VL和VH 是与抗原结合的部位,单体由一对L链和一对H链组成的基本结构,只有2 个与抗原结合的位点,如IgG、IgD、IgE、血清型IgA;双体由J链连接的两个单体,有4 个与抗原结合的位点,如分泌型IgA(SIgA),所以SigA 结合抗原的亲合力要比血清型IgA 高。五聚体由J 链和二硫键连接五个单体,如IgM。五聚体IgM 理论上应为10 个与抗原结合的位点,但实际上由于立体构型的空间位阻,―般只有5 个结合点可结合。
免疫球蛋白
H和L链上都有可变区,同类重链和同型轻链的近N端约110个氨基酸序列的变化很大,其他部分的氨基酸序列相对恒定,据此可将轻链和重链区分为可变区(V)和恒定区(C)。VH和VI。各有3个区域的氨基酸组成和排列顺序高度变化,称为高变区(HVR)或互补决定区(CDR),分别为CDRl、CDR2和CDR3。CDR以外区域的氨基酸组成和排列顺序相对不易变化,称为骨架区(FR)。VH和VI。各有113和107个氨基酸残基,组成4个FR(分别为FRl、FR2、FR3和FR4)和3个CDRs。VH和VI-中的各氨基酸可编号,一些保守的氨基酸都有其固定的编号位置,将不同序列和已编号的序列进行对比以后,在某个位置上多出来氨基酸编号为A、B、C等,如27A、27B、27C、106A等。VH和VL的3个CDR共同组成Ig的抗原结合部位,识别及结合抗原,并决定抗体识别的特异性。
免疫球蛋白轻、重链可变区氨基酸顺序的编号
重链和轻链的C区分别称为CH和CL,不同型别(x或入)CI。的长度基本一致.但不同类别IgCH的长度不一,有的包括CHl~CH3,有的为CHl~CH4。同一种属生物体内针对不同抗原的同一类别Ig的C区氨基酸组成和排列顺序比较恒定,其抗原性是相同的,但V区各有不同。C区与抗体的效应功能相关,可激活补体,介导穿过胎盘和黏膜屏障,结合细胞表面的Fc受体从而介导调理作用、ADCC作用和I型超敏反应。
在Ig分子伸出的两臂和主干之间(CHl与CH2之间)还有个可弯曲的区域,称为铰链区。该区含有丰富的脯氨酸,因此易伸展弯曲,能改变两个结合抗原的Y形臂之间的距离,两臂之间的角度可自0到90变化,这样有利于两臂同时结合两个不同的抗原表位。虽然IgD、IgG、IgA有绞链区,而IgM和IgE没有,但这并不说明它们完全不能弯曲,实际上还有相对的弯曲性。各类抗体的铰链区的长度及氨基酸的顺序也有不同;人IgD的可伸展的距离最大,IgG4和两种IgA的弯曲度则有限。
免疫球蛋白_免疫球蛋白 -主要分类
免疫球蛋白可分为五类,即免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE),IgG,IgA和IgM还有亚类。
IgG,IgD,IgE均为单体,分泌液中IgA(SIgA)是双体,IgM是五聚体。
免疫球蛋白IgG
免疫球蛋白
人体血清免疫球蛋白的主要成分是IgG ,它占总的免疫球蛋白的70-75%,,分子量约15万,含糖2~3%。尽管免疫球蛋白千变万化,但都有类似的结构。抗体分子是由两对长短不同的多肽链所组成,四条链通过链间二硫键构成Y型基本结构(H2L2)。IgG分子由4条肽链组成。其中分子量为2.5万(23kD)的肽链,称轻链(L链),分子量为5万的肽链(50~60kD),称重链(H链)。轻链与重链之间通过二硫键(―S―S―)相连接。免疫球蛋白的作用人体血清免疫球蛋白IgG是初级免疫应答中最持久、最重要的抗体,它仅以单体形式存在。大多是抗菌性、抗毒性和抗病毒抗体属于IgG,它在抗感染中起到主力军作用,它能够促进单核巨噬细胞的吞噬作用(调理作用),中和细菌毒素的毒性(中和毒素)和病毒抗原结合使病毒失去感染宿主细胞的能力(中和病毒)。IgG 在机体合成的年龄要晚于IgM,在出生后第3 个月开始合成,3-5 岁接近成年人水平。它是唯一能通过胎盘的Ig,在自然被动免疫中起重要作用。此外,IgG 还具有调理吞噬和结合SPA等作用。IgA 分血清型和分泌型两种,血清型多为单体,也有二聚体,分泌型的都是二聚体,且含有分泌片。血清型IgA可介导调理吞噬ADCC 作用;分泌型IgA(SIgA)是机体粘膜防御系统的主要成分,复盖在鼻、咽、气管、肠和膀胱粘膜的表面,它能抑制微生物在呼吸道上皮附着,减缓病毒繁殖,是粘膜重要屏障,对某些病毒、细菌和―般抗原具有抗体活性,是防止病原体入侵机体的第一道防线。外来抗原进入呼吸道或消化道,局部免疫系统受到刺激后,无需中央免疫系统的参与,自身就可进行免疫应答,产生分泌型抗体,即SIgA。已有研究证明,呼吸道分泌液中SigA 含量的高低直接影响呼吸道粘膜对病原体的抵抗力,两者呈正相关。初乳中含有分泌型的sIgA。IgA的凝聚物可以通过经典途径激活补体。IgM 是抗原刺激诱导体液免疫应答中最先产生的Ig ,IgM 不是细胞,但可结合补体,主要分布于血清中。由于IgM 有较高的结合价,所以是高效能的抗生物抗体,其杀菌、溶菌、促吞噬和凝集作用比IgG 高500- 1000 倍,IgM 在机体的早期防御中起着重要的作用。
免疫球蛋白lgE
基本简介
是一类具有δ链的亲同种细胞抗体,是参与过敏性鼻炎、过敏性哮喘和湿疹等发病机制调节的主要抗体。自1966年日本学者Ishizaka发现IgE以来,有关IgE的研究已取得重大进展,并先后在肥大细胞、嗜碱细胞、嗜酸细胞和巨噬细胞表面发现了IgE受体,还分别从各种过敏性疾病患者包括过敏性哮喘患者血清中分离出针对多种花粉、尘螨、霉菌和动物皮毛的特异性IgE,近年证实许多细胞因子如IL-4、γ-干扰素均参与了IgE合成的调节。IgE抗体既能启动速发相过敏反应,也可诱发迟发相过敏反应
分子组成
应用DNA序列分析和X晶体衍射分析等研究表明,许多细胞膜表面和机体某些蛋白质分子,其多肽链折叠方式与Ig折叠相似,在DNA水平和氨基酸序列上与IgV区或C区有较高的同源性,它们可能从同一原始祖先基因(primodial ancestral gene)经复制和突变衍生而来。编码这些多肽链的基因称为免疫球蛋白基因超家族(immunoglobulin gene superfamily),这一基因超家族所编码的产物称为免疫球蛋白超家族(immunogloblin superfamily,IGSF)。
(一)免疫球蛋白超家族的组成
由于细胞表面标记、单克隆抗体以及基因工程研究的进展,近年来发现属于IGSF的成员已达近百种,主要包括T细胞、B细胞抗原识别受体和信号传导分子,MHC及相关分子,Ig受体,某些细胞因子受体,神经系统功能相关分子,以及部分白细胞分化抗原(CD)。
(二)免疫球蛋白超家族的特点
1.IGSF的结构特点 IGSF的成员均含有1~7个Ig样功能区,第个Ig样功能区约含100(70~110)个氨基酸残基,功能区的二级结构是由3~5个股反平行β折叠股各自形成两个平行β片层的平面(anti-paralle β-pleated sheet),每个反平行β折叠股由5~10个氨基酸基组成,β片层内侧的疏水性氨基酸起到稳定Ig折叠的作用,大多数功能区内有一个二硫键,垂直连接两个β片层,形成二硫键的两个半胱氨酸间有55~75个氨基酸残基,使之成为一个球形结构,肽链的这种折叠方式称为免疫球蛋折叠(Ig fold)。
根据IGSF功能区中Ig折叠方式、两个半胱氨酸之间氨基酸残基的数目以及与IgV区或C区同源性的程度,IGSF功能区可分为V组、C1组和C2组。
(1)V组:V组功能区的两个半胱氨酸之间含65~75个氨基酸残基,有9个反平行β折叠股,如IgH链和L链V区,TCRα、β、γ、δ链V区,CD4v区,CD8α、β链V区,Thy-1,pIgR和分泌成分(SC)N端四个功能区,CEAN端第一个功能区,PDGFR靠近胞膜的功能区等。
(2)C1组:又称C组。C1组功能区二个半胱氨酸之间约含50~60个氨基酸残基,有7个β折叠股,如IgH链和L链C区(γ、δ和α链的CH1~CH3或μ和ε链的CH1~CH4),TCRα、β、γ、δ链C区,MHc Ⅰ类分子重链α3功能区,β2M,MHCⅡ类分子α2和β2功能区,CD1、Qa和TL靠近胞膜功能区等。
(3)C2组:又称H组。C2组功能区的氨基酸排列的顺序类似V组,但形成二硫键的两个半胱氨酸之间所含氨基酸残基数约为50~60,有7个β折叠股,这种结构介于V组和C1组之间,如CD3γ、δ和ε链,CD2和LFA-3(CD58),pIgR靠近胞膜功能区,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα链、FcαR,ICAM-1,CEA第2至7个功能区,IL-6R、M-CSFR、G-CSFR、SCFR。PDGFR第1至4功能区,以及N-CAM、CD22、CD48分子等。
IGSF功能特点
IGSF的功能是以识别为基础,因此又称为识别球蛋白超家族(cognoglobulin superfamily)。IGSF很可能最起源于原始的具有粘功能的基因,通过复制和突变衍生形成了识别抗原、细胞因子受体、IgFc段受体、细胞间粘附分子以及病毒受体等不同的功能区。IGSF识别的基本方式有以下几种。
(1)IGSF和IGSF相互识别:
① 同嗜性相互作用(heterophilic interaction)如相同神经细胞粘附分子(N-CAM)之间的相互识别,血小板内皮细胞粘附分子-1(PECAM-1,CD31)的相互识别;
② 异嗜性相互作用(heterophilic interaction),如CD2与LFA-3,CD4与MHCⅡ类分子的单态部分(α2和β2),CD8与MHCⅠ类分子的单态部分(α3),poly IgR与多聚Ig,FcγRⅠ (CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)与IgG Fc 段,FcγRⅠ与Ige Fc段,FcαR(CD89)与IgA Fc段,CD28与B7/BB1(CD80)等之间的相互识别。
(2)IGSF和结合素(integrin)相互识别:如ICAM-1(CD54)、ICAM-2(CD102)与LFA-1(CD11a/CD18),VCAM-1(CD106)与VLA-4(CD49d/CD29)之间的相互作用。
(3)IGSF和其它分子的相互识别:包括TCR识别MHCⅠ类或Ⅱ类分子与抗原复合物,细胞因子受体识细胞因子等。
免疫球蛋白_免疫球蛋白 -副作用
1.疫苗可能接种失败,给母肾的功能增加压力。
2.可能会使乙肝病毒发生变异,给治疗带来困难。
3.可能会形成抗原抗体复合物,有潜在危险。
免疫球蛋白_免疫球蛋白 -运动与免疫球蛋白
一般认为,运动强度是淋巴B细胞分泌功能改变的首要因素,如强度过小或时间不长,则不会引起抗体水平的变化。
Edwards 等报道,5min 强度的上下楼梯跑后,B细胞不会发生显着的改变。Hanson 等在观察运动员75%VO2max 跑8-12km 后血中抗体也没有显着变化;Ricken(1990)和Nieman(1991)指出长期有氧训练会引起机体IgG、IgA、IgM 水平提高,机体免疫功能增强。余学好通过对普通学生和太极拳运动员进行一些免疫机能的指标测试发现,长期坚持太极拳运动的实验组,血清中的IgM 含量有显着性提高,并且,实验组无论运动前还是运动后,血清中的IgG,IgA,IgM 含量都显着高于对照组。另外,如气功、太极拳、健身操等运动均可使抗体水平提高;蒋桂凤等研究健身操对女大学生机体免疫球蛋白的影响中得出,每周参加3 次锻炼者,血清IgG 含量比对照组及每周锻炼1次者高,且在第10 周与第12 周存在显着性差异;而实验组间及与对照组血清IgM、IgA 含量差异无显着性。但也有不同结论,如 Michell 等对11 名青年受试者进行了12 周有氧训练,观察运动对人体淋巴细胞功能的影响,测试指标包括免疫球蛋白含量的影响,发现中等强度运动IgA,IgM 会显着下降。这些与前述结论相矛盾的原因可能与实验设计、运动方式、实验系统的差异有关。但是长时间的或高强度的运动对于身体免疫力反而有着不利的影响。长时间高强度运动导致免疫抑制反应,增加急性传染病的易感源,降低机体抗感染的免疫机能。中国学者娇伟研究首次发现,持续的大运动量训练可使运动员血清出现免疫抑制蛋白,其分子量为140KD,说明免疫抑制蛋白在运动与免疫的调节中发挥着作用;Tvede 用溶血空斑法检测抗体部分细胞(B 细胞),发现降低,但偶尔几次剧烈运动对主要免疫球蛋白IgG 的浓度基本上无影响,过度训练也仅引起轻微的降低,主要表现在淋巴细胞的数量及免疫球蛋白的水平下降,这种免疫球蛋白的降低随着运动训练负荷的增加而显着加剧。任保莲观察一次大运动量训练课和400m 跑对女子田径运动员免疫球蛋白IgA、IgM、IgG 的影响结果表明大运动量训练后即刻,IgA、IgM 显着升高,IgG 非常显着增高;恢复3h 后,IgM 仍然显着高于训练前水平,IgA、IgG 已恢复到训练前水平。唐苏丽等观察国家女子手球运动员大负荷训练期末血清免疫球蛋白的变化情况得出:大运动负荷后运动员IgA、IgM 水平显着性降低,表明大负荷强度运动疲劳后机体出现免疫抑制,疾病易感性增加。中国学者观察到长跑运动员冬训期间,在加大运动量初期1 个月,IgG,IgA 含量显着下降,IgM无明显变化,冬训2个月后IgG,IgA 均已恢复正常。PtrovaI.V 等发现,高水平运动员的血清免疫球蛋白水平降低,而随着训练强度的增加,其非特异性免疫机能同样明显降低;浦钧宗等研究不同训练量对动物免疫指标的影响指出:5 周游泳训练后小鼠抗原引起的抗体应答受到抑制,抗体产生水平较对照组明显降低;还有研究指出在剧烈运动或几星期的强度运动后,抗体产生改变,运动员以高强度跑45km 或75km 时,血清免疫球蛋白减少10%- 28% 达2d 之久。分泌型抗体IgA(SIgA)在粘膜表面起着重要的防御作用,运动后即刻能减少唾液SigA 的含量,慢性高强度训练导致SigA 降低可持续一段时间,所以长时间剧烈运动会抑制机体粘膜的免疫功能,这可能是运动员在训练或比赛后更易患上呼吸道感染的原因。
普遍认为适度运动可增强免疫功能,长时间大强度运动会降低运动员的免疫功能,而免疫功能的下降恰恰是一次次过渡训练未能充分恢复造成免疫抑制累积的结果,因此进行体育锻炼时不能掉入“运动越多越大越好”的误区,需掌握自身体育锻炼的最佳范围,以达到真正强身健体的目的。
免疫球蛋白与疾病
所有的抗体是Ig,但Ig并不都是抗体。Ig的两个重要特征是特异性和多样性。它们是机体受抗原(如病原体)刺激后产生的,其主要作用是与抗原起免疫反应,生成抗原-抗体复合物,从而阻断病原体对机体的危害,使病原体失去致病作用。另一方面,免疫球蛋白有时也有治病作用。临床上的过敏症状如花粉引起的支气管痉挛,青霉素导致全身过敏反应,皮肤荨麻疹(俗称风疹块)等都是由免疫球蛋白制剂能增强人体抗病毒的能力,可作药用。如注射人血清或人胎盘中提取的丙种球蛋白制剂可防治麻疹、传染性肝炎等传染病。Ig是一个多
 爱华网
爱华网