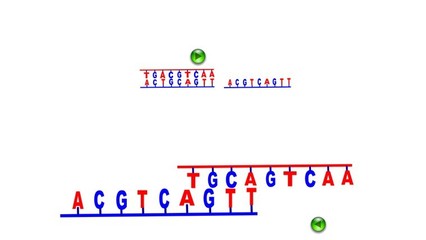
荧光原位杂交方法是一种物理图谱绘制方法,使用荧光素标记探针,以检测探针和分裂中期的染色体或分裂间期的染色质的杂交。
荧光原位杂交_荧光原位杂交 -荧光原位杂交(FISH)技术详解
1974年Evans首次将染色体显带技术和染色体原位杂交联合应用,提高了定位的准确性。20世纪70年代后期人们开始探讨荧光标记的原位杂交,即FISH技术。1981年Harper成功地将单拷贝的DNA序列定位到G显带标本上,标志着染色体定位技术取得了重要进展。20世纪90年代,随着人类基因组计划的进行,由于绘制高分辨人类基因组图谱的需要,FISH技术得到了迅速的发展和广泛应用。
原理
FISH(fluorescence in situ hybridization)技术是一种重要的非放射性原位杂交技术。它的基本原理是:如果被检测的染色体或DNA纤维切片上的靶DNA与所用的核酸探针是同源互补的,二者经变性-退火-复性,即可形成靶DNA与核酸探针的杂交体。将核酸探针的某一种核苷酸标记上报告分子如生物素、地高辛,可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应,经荧光检测体系在镜下对待测DNA进行定性、定量或相对定位分析。
实验流程
FISH样本的制备→探针的制备→探针标记→杂交→(染色体显带)→荧光显微镜检测→结果分析。
特点
原位杂交的探针按标记分子类型分为放射性标记和非放射性标记。用同位素标记的放射性探针优势在于对制备样品的要求不高,可以通过延长曝光时间加强信号强度,故较灵敏。缺点是探针不稳定、自显影时间长、放射线的散射使得空间分辨率不高、及同位素操作较繁琐等。采用荧光标记系统则可克服这些不足,这就是FISH技术。FISH技术作为非放射性检测体系,有以下特点。
优点:1、荧光试剂和探针经济、安全;2、探针稳定,一次标记后可在两年内使用;3、实验周期短、能迅速得到结果、特异性好、定位准确;4、FISH可定位长度在1kb的DNA序列,其灵敏度与放射性探针相当;5、多色FISH通过在同一个核中显示不同的颜色可同时检测多种序列;6、既可以在玻片上显示中期染色体数量或结构的变化,也可以在悬液中显示间期染色体DNA的结构。
缺点:不能达到100%杂交,特别是在应用较短的cDNA探针时效率明显下降。
应用
该技术不但可用于已知基因或序列的染色体定位,而且也可用于未克隆基因或遗传标记及染色体畸变的研究。在基因定性、定量、整合、表达等方面的研究中颇具优势。
FISH最初用于中期染色体。从正在分化的细胞核中制备的这种染色体是高度凝缩的,每条染色体都具有可识别的形态,它们染色后将显现出特征性的着丝粒位置及染色带型。在处理中期染色体时,通过测定FISH所获得荧光信号相对于染色体短臂末端的位置(FLpter值)来进行作图。使用中期染色体的不足之处在于,由于它的高度凝缩的性质,只能进行低分辨率作图,两个标记至少分隔1Mb才能作为分开的杂交信号被分辨出来(Trask et al.,1991)。这种分辨率不足以构建有交往的染色体图谱。故此中期染色体FISH主要用于确定新标记在染色体上的大概位置,为其他更精细的作图方法做准备。 一直以来,这些“其他方法”并不包括任一种FISH,但1995年后,一系列高分辨率的FISH技术已发展起来。这些技术通过改变待研究的染色体制备的性质而达到较高的分辨率。中期染色体对于精细作图来说凝缩度太高,因而我们需要选用较为伸展的染色体。有两种途径可以满足这一要求(Heiskanen et al.,1996): 机械伸展的染色体(mechanically stretched chromosome)通过改变从中期细胞核中分享染色体的方法而获得。离心产生剪切力可将染色体伸展到正常长度20倍。每条染色体仍可识别,而FISH信号作图方法与通常处理的中期染色体相同,这样,分辨率可明显提高,能够区分出相隔200~300kb的标记。 非中期染色体(non-metaphase chromosome)染色体仅在中期高度凝缩,而在细胞周期的其他阶段保持天然未包装状态,有研究者曾利用前期细胞核,此时染色体凝缩程度足以区分出单个染色体。实际应用中,这种方法并无优于机械伸展的染色体之处。相比之下分裂间期(interphase)的染色体更为有用,因为分裂间期(再次细胞核分裂之间)的染色体包装程度最低。使用分裂间期的染色体,分辨率有可能达到25kb以下,但染色体形态特征消失,推动了定位探针位置所需的外部参照点。因此,该技术可在已获得染色体粗略图谱后使用,通常作为确定染色体一段小区域内一系列标记物顺序的方法。 间期染色体含有去组装的全部的细胞DNA分子。为了进一步提高FISH的分辨率到25kb以下,有必要放弃完整的染色体,而使用纯化的DNA。这种方法叫做纤维-FISH(fiber-FISH),利用凝胶拉伸或分子梳理技术制备DNA,可以分辨间距小于10kb的标记。
荧光原位杂交_荧光原位杂交 -荧光原位杂交技术的发展历程
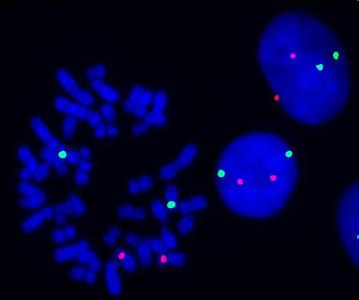
FISH技术检测位点数目及检测目标的发展
在FISH 技术基本确立之后,FISH 不仅用于单基因或核酸检测,FISH 技术的进一步发展扩展到多色FISH 多基因位点同时检测,从基因检测发展到基因组、染色体、活细胞中转录产物mRNAs 原位检测以及组织水平的核酸检测,并且在今后的研究中还有可能应用到整个生物体的检测。早期的探针较大,是通过载体的增殖、缺口平移法、体外转录法和随机引物DNA 合成法来制备以获得特异性杂交克隆。然而大片断的探针通常带有重复序列造成高荧光背景,采用未标记的核酸进行预处理使其与非特异性位点结合用于抑制非特异性杂交可以克服上述问题,同时也使得研究者扩大了检测目标,实现了整条染色体染色。在细胞遗传学上FISH 技术在染色体分析方面也因此得到了显着的提高。如通过比较基因组杂交(Comparativegenomic hybridization)用于检测染色体区域的缺失和重复。大片段探针一旦和样品非特异性结合就会形成一个信号,混淆染色体上基因的检测,就需要剪切成小片段
FISH 检测范围的扩大,使得FISH 技术的应用在20 世纪90 年代急速增长。由FISH 技术应用而形成的分支技术实现了越来越多的不同类型位点同时检测。首先是采用不同的荧光素来检测多位点,如双色荧光用于检测特异的核酸序列,每一条染色体、基因或者转录产物分别由一种可以分辨的荧光信号来表示。之后是采用两种色彩译码方案进一步扩大了FISH 应用范围。译码方案主要是针对色彩比例,即每一种颜色在总颜色中所占的比例来描绘多位点。前述的每一种方法,或是两种方法的结合都已经将可检测位点多达12 个。采用计算机翻译的五色方案可同时检测出人类所有染色体代表着FISH 技术多位点检测的里程碑。尽管可以采用多种方法观测到mRNAs,但是FISH 对整个转录产物的原位分析似乎更有应用前景。色彩译码技术已经实现了对整个组织的检测。
FISH技术的定量分析阶段
Pinkel 等(1986)首次将荧光图像定量分析用于基本细胞遗传检测,采用双色激发块装置照相机检测荧光信号,而且定量分析技术很快用于了mRNA 检测。荧光检测的关键是信号的重现性、无规律性及背景的自发荧光。不仅不同的样品之间荧光不同,而且同一载玻片上的材料或者同样的细胞都有可能显示出不均衡的荧光。目前已有多种方法用于消除一些组织中的自发荧光:如样品制备过程中,采用的消除自发荧光试剂包括硼氢化钠或者采用光照辐射进行预处理以消除非特异性背景信号。这些消除自发荧光的方法并不完全有效,通常在进行图像分析时通过计算机算术除去自发荧光信号。荧光图像的光谱数据包括真正的信号和许多杂噪,分别进行分析并且通过单独的光谱组分分析除掉杂噪数据。多色FISH 有自身的限制,包括不同的荧光强度和颜色重叠。但是通过计算机算法分析平衡了多色图像,包括强度变化和自动纠正信号重叠。
FISH图像自身的限制并没有影响到自动破译算法的发展。采用序列较大探针进行DNA 位点检测和多色荧光计数算法辅助病理学家实现了自动化分析。此外,检测探针试剂盒和点计数方法的应用为便捷的检测结果提供了一个平台。尽管多种方法已经用于分析或优化自动细胞检测系统,人工的细胞病理检测仍是可信度高的组织分析方法。然而,细胞制备、鉴别、固定介质上细胞样品计算机化检测在未来的医学诊断中的高效益性不容忽视,快速检测细胞内的分子信号只有通过计算机辅助方法进行检测。现在,自动化检测程序已经扩展到采用多基因转录模型检测特异的DNA 簇和转录位点以确定功能细胞的状态。
FISH技术检测领域的发展
鉴于FISH 起始阶段的发展主要是探针类型和检测位点的扩展,荧光检测技术将来的发展可能包括检测领域的扩展。荧光图像临床诊断应用需要在检测体系上进一步提高,如探针的结合,照相和分析的自动化,因此避免了不同操作间的误差。样品厚度是荧光显微镜检测样品类型的一个限制因素。近来的激光共聚焦显微镜和光学X射线断层摄影技术要求样品厚度达到1~2mm。一种改进的光学投射X 显微断层摄影技术可以获取到15mm 厚样品的图像扩大了生物学和诊断样品的检测范围。活细胞的RNAs FISH 技术检测也有报道。既可以采用体内释放的荧光集团也可以采用杂交后探针的荧光素进行检测。这两种新方法都可以降低非特异性标记探针存在时的高背景(如活细胞),可以用于追踪mRNA 的合成和转移途径。这些方法较绿色荧光蛋白(Green fluorescence protein, GFP)更易于检测不同靶分子。相对于GFP 活细胞原位杂交检测,FISH 易受到细胞内合成探针的影响。FISH 需要进一步的改进以降低活体基因表达检测时的干扰背景,避免细胞内自身杂交物的干扰。其实完全可以不必考虑FISH 检测和荧光检测蛋白技术的差异,将FISH 技术和荧光蛋白技术结合起来可以同时检测目的核酸和蛋白。
多光子显微技术的应用进一步扩大了荧光图像的应用范围。采用多光子显微镜,激光块可以发射光子聚焦于显微镜两到三次激发目的荧光素。采用近红外激发光可以更深层次穿透生物样品,比可见光对活体样品造成的毒性低。这种新方法的应用已将荧光图像用于活体系统的检测,甚至整个动物体。由于还不能合成生物体标记探针,因此目前生物体内荧光图像的应用只限于检测荧光分子或生物体自发荧光。生物组织在正常的生理或者病理生理过程中产生的自发荧光信号可以作为一种重要的诊断信号。一旦生物体探针成为可能,将会成为鉴别特异核酸序列,进行非入侵诊断,获取诊断图像的一种有力辅助手段。
 爱华网
爱华网