聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr)单体和少量交联剂甲叉双丙烯酰胺(简称Bis)通过化学催化剂(过硫酸铵),四甲基乙二胺(TEMED)作为加速剂或光催化聚合作用形成的三维空间的高聚物。聚合后的聚丙烯酰胺凝胶形成网状结构。具有浓缩效应、电荷效应、分子筛效应。血清蛋白在聚丙烯酰胺凝胶电泳一般可分成12~25个组分。因此适用于不同相对分子质量物质的分离,且分离效果好。
聚丙烯酰胺凝胶_聚丙烯酰胺凝胶电泳 -名称
聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶_聚丙烯酰胺凝胶电泳 -简介
聚丙烯酰胺凝胶电泳作用:用于分离蛋白质和寡核苷酸。作用原理聚丙烯酰胺凝胶为网状结构,具有分子筛效应。它有两种形式:非变性聚丙烯酰胺凝胶及SDS-聚丙烯酰胺凝胶(SDS-PAGE);非变性聚丙烯酰胺凝胶,在电泳的过程中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开。
而SDS-PAGE仅根据蛋白质亚基分子量的不同就可以分开蛋白质。该技术最初由shapiro于1967年建立,他们发现在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小(可以忽略电荷因素)。
聚丙烯酰胺凝胶_聚丙烯酰胺凝胶电泳 -补充信息
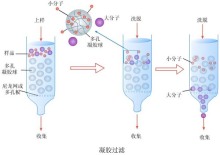
聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamidegelelectrophoresis)聚丙烯酰氨凝胶电泳,是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术。聚丙烯酰胺凝胶由单体丙烯酰胺和甲叉双丙烯酰胺聚合而成,聚合过程由自由基催化完成。催化聚合的常用方法有两种:化学聚合法和光聚合法。化学聚合以过硫酸铵(AP)为催化剂,以四甲基乙二胺(TEMED)为加速剂。在聚合过程中,TEMED催化过硫酸铵产生自由基,后者引发丙烯酰胺单体聚合,同时甲叉双丙烯酰胺与丙烯酰胺链间产生甲叉键交联,从而形成三维网状结构。PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。不连续体系由电极缓冲液、浓缩胶及分离胶所组成。浓缩胶是由AP催化聚合而成的大孔胶,凝胶缓冲液为pH6.7的Tris-HCl。分离胶是由AP催化聚合而成的小孔胶,凝胶缓冲液为pH8.9Tris-HCl。电极缓冲液是pH8.3Tris-甘氨酸缓冲液。2种孔径的凝胶、2种缓冲体系、3种pH值使不连续体系形成了凝胶孔径、pH值、缓冲液离子成分的不连续性,这是样品浓缩的主要因素。
聚丙烯酰胺凝胶_聚丙烯酰胺凝胶电泳 -作用
SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白-SDS胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。SDS-PAGE一般采用的是不连续缓冲系统,与连续缓冲系统相比,能够有较高的分辨率。
浓缩胶的作用是有堆积作用,凝胶浓度较小,孔径较大,把较稀的样品加在浓缩胶上,经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。当样品液和浓缩胶选TRIS/HCL缓冲液,电极液选TRIS/甘氨酸。电泳开始后,HCL解离成氯离子,甘氨酸解离出少量的甘氨酸根离子。蛋白质带负电荷,因此一起向正极移动,其中氯离子最快,甘氨酸根离子最慢,蛋白居中。电泳开始时氯离子泳动率最大,超过蛋白,因此在后面形成低电导区,而电场强度与低电导区成反比,因而产生较高的电场强度,使蛋白和甘氨酸根离子迅速移动,形成以稳定的界面,使蛋白聚集在移动界面附近,浓缩成一中间层。
此鉴定方法中,蛋白质的迁移率主要取决于它的相对分子质量,而与所带电荷和分子形状无关。
聚丙烯酰胺凝胶_聚丙烯酰胺凝胶电泳 -相关资料
聚丙烯酰胺凝胶电泳(SDS-PAGE)一、目的要求
(1)学习电泳原理和技术
(2)学习和掌握SDS-聚丙烯酰胺凝胶圆盘电泳分离蛋白质技术
二、实验原理

聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr)单体和少量交联剂甲叉双丙烯酰胺(简称Bis)通过化学催化剂(过硫酸铵),四甲基乙二胺(TEMED)作为加速剂或光催化聚合作用形成的三维空间的高聚物。聚合后的聚丙烯酰胺凝胶形成网状结构。具有浓缩效应、电荷效应、分子筛效应。血清蛋白在聚丙烯酰胺凝胶电泳一般可分成12~25个组分。因此适用于不同相对分子质量物质的分离,且分离效果好。
聚丙烯酰胺凝胶作为电泳材料的特性
人工合成聚丙烯酰胺凝胶的化学体系的组成及功能:
Acr:丙烯酰胺
Bis:甲叉双丙烯酰胺
AP:过硫酸铵――化学催化剂
TEMED:四甲基乙二胺――加速剂
SDS是一种阴离子去垢剂,SO32-带负电荷。在含有强还原剂的SDS溶液中可形成SDS-蛋白质复合物。由于结合大量带负电荷的SDS,好比蛋白质穿上带负电的“外衣”,蛋白质本身带有的电荷则被掩盖了。从而起到消除各蛋白质分子之间自身的电荷差异的作用。
三、实验材料
(一)试剂
1、30%丙烯酰胺混合液(Acr:Bis 为29:1) 称取丙烯酰胺(Acr)29g及甲叉丙烯酰胺(Bis)1.0g,用去离子水溶解并稀释至100ml,贮棕色瓶中于4℃保存,可用一个月。
2、1.5mol/L pH8.8 Tris-HCl缓冲液取1mol/L HCL溶液48ml、三羟甲基甲烷(Tris)36.6g,加双蒸馏水至80ml使其溶解,调pH至8.8,然后用双蒸馏水稀释至100ml,置棕色瓶中,4℃贮存。
3、1.0mol/LpH6.8Tris-HCl缓冲液取1mol/L HCL溶液48ml,Tris5.98g,加双蒸馏水至80ml,调pH6.8,用双蒸馏水稀释至100ml,置棕色瓶中,4℃贮存。
4、Tris-甘氨酸电泳缓冲液 称取Tris 6g、甘氨酸28.8g,加蒸馏水850ml,调pH至8.3,加蒸馏水到1000ml,4℃贮存。用时可做10倍稀释。
5、10% 过硫酸铵(AP)(6)四甲基乙二胺(TEMED)或β-二甲基氨基丙腈(DMAPN)。
6、10%SDS(十二烷基磺酸钠) 称取SDS 10g,加蒸馏水100ml使其溶解。
7、四甲基乙二胺(TEMED)
8、上样缓冲液取1.0mol/LpH6.8Tris-HCl缓冲液6.25ml,蔗糖10g,SDS 2.3g,1g/L溴酚蓝10ml,加蒸馏水溶解,混合至100ml。
9、考马斯亮蓝染色试剂考马斯亮蓝R250染色液:浓度为2.5g/L,用甲醇∶醋酸∶蒸馏水=5∶1∶5的溶液配制(V/V)。
10、脱色液:取冰醋酸7.5ml、甲醇5ml,加蒸馏水至100ml。
11、样品:人血清。
12、蛋白质分子量标志物市售中分子量蛋白质分子量标志物。也可选择5种以上的已知分子量蛋白质自行配制,注意其分子量分布要能满足需要,各种蛋白质的浓度基本相等。
(二)仪器圆盘电泳槽(或垂直板电泳槽)、稳压稳流电泳仪、脱色摇床。
四、实验方法
(一)准备圆盘电泳槽、电泳仪。
(二)凝胶制备按下表分别配制分离胶和浓缩胶(此量可供2人用)
分离胶(12% 5ml) 浓缩胶(5% 2ml)
ddH2O 1.6ml 1.4ml
30%混合液 2.0ml 0.33ml
1.5mol/L pH8.8 Tris-HCl 1.3ml ―
1.0mol/L pH6.8 Tris-HCl ― 0.25ml
10%SDS 50µl 20µl
10%Ap 50µl 20µl
TEMED 4µl 4µl
注意:边配边平摇烧杯混匀,配好胶后迅速用滴管灌胶
(三)灌胶
1、先将胶管(5х90mm)封好底,将配制好的分离胶液灌注入胶管内,约70mm高度(掌握分离胶的高度),在凝胶表面轻轻加一层正丁醇液(约3~4mm)。用于隔绝空气,使胶面平整。室温下静置约30~60min。观察胶和正丁醇之间的界面,判断胶是否凝固。要在确认分离胶彻底凝固后才开始配制浓缩胶。
2、分离胶凝固好后,倒掉覆盖在分离胶表面的正丁醇,并用去离子水冲洗一次,倒置吸净残留的水。将配制好的浓缩胶液灌注入胶管内(约15mm),在凝胶表面轻轻加一层正丁醇液(约3~4mm),用于隔绝空气,使胶面平整。室温下静置约30~60min。观察胶和正丁醇之间的界面,判断胶是否凝固。胶凝固好后,倒掉覆盖在胶表面的正丁醇,并用去离子水冲洗一次,倒置吸净残留的水,准备加样。
(四)样品预处理和加样
1、取血清0.1ml、上样缓冲液0.9ml,混匀,在沸水中煮沸5min。
2、将胶管封底去掉,放入圆盘电泳槽中,套紧,不能有空的孔,将Tris-甘氨酸电泳缓冲液加入圆盘电泳上、下槽中,电泳缓冲液要盖过胶管口,然后用微量加样器(或注射器)将样品10μl加到胶管胶面内。
(五)电泳上槽接负极,下槽接正极,先调电压为120v/浓缩胶,开始电泳,当指示染料进入分离胶后,将电压增加到80v/分离胶胶,继续电泳直至染料抵达距分离胶下端约1cm处,停止电泳,断开电源。电泳时间约1.0~1.5h。
(六)考马斯亮蓝染色
电泳结束后,取出电泳胶管,用长注射器针剥胶,一边注水一边推胶,直至胶出。将胶移至大培养皿中,精确量取并记录凝胶长度和指示染料的迁移距离(分离胶上缘到染料条带中心距离),然后将凝胶板浸入考马斯亮蓝染色液中0.5-1h,再用脱色液脱色1~2天,至背景无色为止。区带可作定性或定量分析。
(七)校正曲线的数据处理和分子量测定精确量取并记录染色后凝胶长度、各标志蛋白质和各待测蛋白质区带的迁移距离(分离胶上缘到各蛋白质区带中心)。按下式计算各蛋白质的相对迁移率(Rm值)。
Rm =
在半对数纸上,以各标志蛋白质的Rm值为横坐标(普通尺度),相应的分子量为纵坐标(对数尺刻度)作图,即得分子量校正曲线。根据各待测蛋白质的Rm值,查此校正曲线,可求各待测蛋白质的相对分子量。
五、注意事项
1.制胶过程中用正丁醇封住胶面是为了阻止空气中的氧气对凝胶聚合的抑制作用。
2.本法也适合于其他生物样品中蛋白质的分析。上样量不宜过大,否则会出现过载现象。尤其是考马斯亮蓝R250染色,在蛋白质浓度过高时,染料与蛋白质的氨基(-NH)形成的静电键不稳定,其结合不符合Beer定律,使蛋白质量不准确。
3.Acr和Bis有神经毒性,可经皮肤、呼吸道等吸收,故操作时要注意保护。
附表1分子量范围与凝胶浓度的关系
蛋白质 核酸(RNA)
分子量范围 适用的凝胶浓度/(%) 分子量范围 适用的凝胶浓度/(%)
<104 20-30 <104 15
 爱华网
爱华网