1.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
A(固)+2B(气) C(气)+D(气)已达平衡的是( )
(A)混合气体的压强 (B)混合气体的密度
(C)B的物质的量浓度 (D)气体总物质的量
2.达到化学平衡的条件是( )
(A)逆反应停止进行 (B)反应物与生成物的浓度相等
(C)正反应与逆反应停止进行 (D)正反应和逆反应的速率相等。
3.在一定温度下,反应A2(气)+B2(气) 2AB(气)达到平衡状态的标志是
(A)单位时间里生成n molA2,同时生成n molAB
(B)容器中的总压不随时间而变化
(C)[A2],[B2],[AB]不随时间而变化
(D)单位时间里生成2nmolAB的同时生成nmolB2。
4.在一定温度下,可逆反应:A2(气)+B2(气) 2AB(气),达到平衡的标志是( )
(A)容器的总压强不随时间而变化
(B)单位时间内有nmolA2生成的同时有nmolB2生成
(C)单位时间内有nmolB2发生反应的同时有nmolAB分解
(D)单位时间内生成nmolA2同时就有2nmolAB生成
5.在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
(A)C的生成速度 与C的分解速度相等
(B)单位时间生成n mol A,同时生成3n mol B
(C)A、B、C的浓度不再变化
(D)A、B、C的分子数比为1:3:2
6.下列反应在密闭容器中进行,aA(g)+bB(g) mC(G)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
(A)平衡时的压强与反应起始的压强之比为m+n/a+b
(B)用物质A表示的反应速度与物质C表示的反应速度之比为a/m
(C)物质B的浓度不随时间而改变
(D)单位时间内x mol B参加反应同时有x mol B生成
7.在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是
(A) 正反应速度 vA=2mol/(L·min)逆反应速度vB=2 mol/(L·min)
(B) 正反应速度 vA=2mol/(L·min)逆反应速度vC=2 mol/(L·min)
(C) 正反应速度 vA=1mol/(L·min)逆反应速度vB=1.5 mol/(L·min)
(D) 正反应速度 vA=1mol/(L·min)逆反应速度vC=1.5mol/(L·min)
8.在一定温度下反应A2(气)+B2(气) 2AB(气)达到平衡的标志是( )
(A)单位时间内生成nmolA2的同时,生成nmolB2
(B)单位时间内生成2nmolAB的同时,生成nmolB2
(C)单位时间内生成了nmolB2的同时,减少了nmolA2
(D)单位时间生成nmolA2,同时生成nmolAB
(E)单位时间内消耗了nmolA2,同时消耗了2nmolAB
9.在一定温度下,下列反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( )
(A)单位时间内生成nmolA2同时生成nmolAB (B)容器内总压强不随时间而变化
(C)单位时间内生成2nmolAB同时生成nmolB2
(D)单位时间生成nmolA2同时生成nmolB2
10.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的是( )
( A )A(气)+B(气) C(气) ( B )A(气)+2B(气) 3C(气)
( C )A(气)+B(气) C(气)+D(气) ( D )以上都达到平衡
11.在一定温度下,A2(气)+B2(气) 2AB(气)达到平衡的标志( )
( A )单位时间生成n摩的A2同时生成n摩的AB
( B )容器内的总压强不随时间变化
( C )单位时间生成2n摩的AB同时生成n摩的B2
( D )单位时间生成n摩的A2同时生成n摩的B2
12.在一定温度下,( )说明可逆反应A2(气)+B2(气) 2AB(气)已达到平衡。
(a)单位时间内生成n摩尔A2,同时生成n摩尔B2
(b)单位时间内生成2n摩尔AB,同时生成n摩尔B2
(c)单位时间内生成n摩尔A2,同时消耗n摩尔B2
(d)容器内的总压强不随时间变化而变化
( A )(a)(b)(c)(d) ( B )只有(a)(b)(c) ( C )只有(b)(c) ( D )只有(b)
13.能够充分说明在恒温下的密闭容器中反应:2SO2+O2 2SO3,已经达到平衡的标志是( )
(A)容器中SO2、O2、SO3共存
(B)容器中SO2和SO3的浓度相同
(C)容器中SO2、O2、SO3的物质的量为2:1:2
(D)容器中压强不随时间的变化而改变
14.在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
(A)N2O4和NO2的分子数比为1:2
(B)N2O4和NO2的浓度相等
(C)平衡体系的颜色一定不再改变
(D)单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4
化学平衡(二)等效平衡典型题
1、一定条件下把2mol SO2和1mol O2充入密闭容器中,反应2SO2+O2 2SO3到达平衡时,若温度不变,用 a、b、c表示起始时SO2、O2和SO3的物质的量。若 a、b、c取值不同,必须满足一定关系才能保证达到平衡时,反应混合物的质量分数与上述平衡时完全相同。则:
(1)a=0 b=0 c=____。
(2)a=0.5 则b=____, c= ____。
(3)a、b、c 取值的一般条件用方程式表示:(一个只含a、c,另一只含 b、c)____、____。
2、某恒温恒压下,向可变容积的密闭容器中充入3升A和2升B,发生如下反应:3A(气)+2B(气) xC(气)+yD(气),达到平衡时C的体积百分比为m%,若维持温度、压强不变,将0.6升A,0.4升B、4升C、0.8升D作为起始物质充入密闭容器内,则达到平衡时C的体积百分比仍为m%,则x=_______,y=________。
3、在一定温度下,把4molA气体和5molB气体通入一个定容积的密闭容器里,发生以下反应:
当此反应进行到一定程度时,反应混合物就处于平衡状态。现在该容器中维持温度不变,令a、b、c、d分别代表初始加入的A、B、C、D的物质的量,如果a、b、c、d取不同的数值,它们必须满足一定的关系,才能保证达到平衡时,反应混合物中几种物质的百分含量仍跟上述平衡时完全相同,请填写下列空白:
(1)若a=0,b=0时,则c=________,d=________;
(2)若a=1,则c=________,d=________;
(3)a、b、c、d取值必须满足的一般条件是(请用方程式表示,其中一个只含a和c,另一个只含b和c)________,________。
4、在一定条件下,四个相同容积的容器中分别充入下列配比的气体
容 器
A
B
C
D
(a)
2摩尔
1摩尔
0
0
(b)
4摩尔
2摩尔
0
0
(c)
1摩尔
0.5摩尔
1.5摩尔
0.5摩尔
(d)
0
0
9摩尔
3摩尔
发生2A(气)+B(气) 3C(气)+D(气)的可逆反应,当达到平衡时,________容器内B的浓度最大;_______和_______容器内四种物质的浓度都相同。
5、在一个固定体积的密闭容器中,保持一定温度,进行以下反应: 已知加入1摩H2和2摩Br2时,达到平衡后生成a摩HBr(见下表“已知”项)。在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)~(3)的状态,填写表中的空白:
编号
起始状态(摩)
平衡时HBr
H2
Br2
HBr
物质的量(摩)
已知
1
2
0
a
(1)
2
4
0
(2)
1
0.5a
(3)
m
n(n>2m)
6、在一定温度下,把2molN2和6molH2通入一个一定容积的密闭容器中,当合成氨反应达到平衡时,测得NH3的百分含量为m。若温度不变,只改变初始加入量,使达平衡时,NH3的百分含量仍为m。令N2、H2、NH3的起始加入量分别用a、b、c表示,请填写下列空白
(1)若a=0,b=0,则c=____________mol
(2)若a=1.5mol,则b=________mol, c=____________mol
(3)a、b、c应满足的一般条件(分别用含a、b、c的两个代数式表示)是________、________
7、在密闭容器中加入4mol A和2mol B发生如下反应
2A(气)+B(气) 3C(气)+D(气)达到平衡时C的浓度为
mmol/L,若温度不变时按下列5种配比作为起始物质,达到平衡后C浓度
仍为mmol/L的是( )
(A)2molA+1molB (B) 4molA+2molB+3molC
(C)3molC+1molD (D) 6molC+2molD
(E) 2molA+1molB+3molC+1molD
8、在一个固定容积的密闭容器中,加以m摩A、2n摩B,发生下列反应: 平衡时C的浓度为W摩/升,若容器体积和温度不变,起始时放入a摩A,b摩B,c摩C,若要平衡后C的浓度仍为W摩/升,则a、b、c必须满足的关系是( )
( A ) = ,且 +a=m ( B ) = 且 +b=n
( C ) < < 且 +a=m, +b=2n ( D )0< < 且 +a=m, +b=2n
化学平衡(三) 图像问题
1. 如图所示,反应:X(气)+3Y(气) 2Z(气)+热量,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为( )
2. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是( )。
(A)Z,W为气体,X,Y中之一为气体
(B)Z,W中之一为气体,X,Y为非气体
(C)X,Y,Z皆为气体,W为非气体
(D)X,Y为气体,Z,W中之一为气体
3. 可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
下列叙述正确的是( )。
(A)达平衡后,加入催化剂则C%增大
(B)达平衡后,若升温,平衡左移
(C)化学方程式中n>e+f
(D)达平衡后,增加A的量有利于平衡向右移动
4. 反应aA(g)+bB(g) cC(g)+Q,生成物C的质量分数与压强P和温度的关系如图,方程式中的系数和Q值符合图象的是( )
(A)a+b>c Q>0 (B)a+b>c Q<0
(C)a+b<c Q<0 (D)a+b=c Q>0
5. 某可逆反应L(s)+G(g) 3R(g)-Q,本图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
(A)平衡混合气中R的质量分数
(B)达到平衡时G的转化率
(C)平衡混合气中G的质量分数
(D)达到平衡时L的转化率
6. 图中表示外界条件(t、p)的变化对下列反应的影响:L(固)+G(气) 2R(气)-Q,y 轴表示的是( )
(A) 平衡时,混合气中R的百分含量
(B) 平衡时,混合气中G的百分含量
(C) G的转化率
(D) L的转化率
7. 在可逆反应mA(g)+nB(g) pC(g)+Q中m、n、p为系数,且m+n>p Q>0。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是( )
8. 在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L
此反应符合下面图像,下列叙述是正确的是( )
(A) 正反应吸热,L是气体
(B) 正反应吸热,L是固体
(C) 正反应放热,L是气体
(D) 正反应放热,L是固体或液体
9. A%为气态反应物在平衡体系中的百分含量,符合曲线的反应是( )
(A)N2(气)+3H2(气) 2NH3(气)+Q
(B)C(固)+CO2(气) 2CO(气)-Q
(C)N2(气)+O2(气) 2NO(气)-Q
(D) CaCO3(固) CaO(固)+CO2(气)-Q
10. 能正确反映出N2+3H2 2NH3+Q的关系的是( )
11. 可逆反应mA(s)+nB(g) pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是( )
(A)到达平衡后,若使用催化剂,C的质量分数增大
(B)平衡后,若升高温度,平衡则向逆反应方向移动
(C)平衡后,增大A的量,有利于平衡向正反应方向移动
(D)化学方程式中一定n>p+q
12. 图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
(A)4NH3(气)+5O2(气) 4NO(气)+6H2O(气)+808.7kJ
(B)N2O3(气) NO2(气)+NO(气)-41.8kJ
(C)3NO2(气)+H2O(液) 2HNO3(液)+NO(气)+261.3kJ
(D)CO2(气)+C(固) 2CO(气)-171.4kJ
13. 对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
(A)m+n<p
(B)n>p
(C)x点的状态是v正>v逆
(D)x点比y点的反应速度慢
14. 由可逆反应测绘出图像,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
(A)反应物中一定有气体
(B)生成物中一定有气体
(C)正反应一定是放热反应
(D)正反应一定是吸热反应
15. 现有可逆反应A(气)+B(气) 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则____曲线是表示压强较大的情况。
16. 在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
A. B. C. D. E.
(1)升温,达到新的平衡的是( )
(2)降压,达到新的平衡的是( )
(3)减少C的量,移向新平衡的是( )
(4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是( )
17. 反应aA(固)+bB(气) cC(气)+dD(气)达到平衡时,B%跟压强P和温度T(T2>T1)
之间的关系如图所示
(1)当压强不变时,升高温度,B%变______,其反应为_______热反应。
(2)当温度不变,增大压强时,B%变_______,平衡向______方向移动,方程式中系数间关系是______________。
(3)当温度不变,增大压强时,若B%不变,则方程式中系数关系是_____________。
18. 密闭容器中mA(g)+nB(g) pC(g),
反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如右图。则:
(1)增大压强,A的转化率____,平衡向____移动,
达到平衡后,混合物中C的质量分数________。
(2)上述化学方程式中的系数m、n、p的正确关系是____,
向上述平衡体系中加入B,则平衡________。
(3)当降低温度时,C的质量分数增大,则A的转化率____,正反应是____热反应。
19.反应 X(气)+ Y(气) 2Z(气)+ Q(Q>0)在一
定条件下,反应物Y的转化率与反应时间(t)的关系如
右下图所示。若使曲线a变为曲线b可采取的措施是
(A)加催化剂 (B)降低温度
(C)增大压强 (D)增大Y的浓度
翰林汇
20.把在空气中久置的铝片5.0 g投入盛有 500 Ml
0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸
反应产生氢气的速率与反应时间可用如右的坐标曲
线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因_______
___________________________,有关的化学方程式为
___________________;
(2)曲线由a→b段产生氢气的速率较慢的原
因_____________________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
化学平衡(四) 化学平衡的移动
1、在一定条件下,N2O4 2NO2-Q可逆反应达到平衡,当分别改变下列条件时,填入N2O4分解率与原分解率的比较情况(增大、减小、不变)。
(1)保持容器容积不变,通入二氧化氮使体系压强增大一倍,则达到平衡时N2O4分解率________。
(2)保持容器容积不变,通入氖气使体系压强增大一倍,则达到平衡时N2O4分解率________。
(3)保持压强不变,通入二氧化氮使体系的容积增加一倍,则达到平衡时N2O4分解率________。
(4)保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时N2O4分解率________。
2、在一定温度下,可逆反应:
ClF(气)+F2(气) ClF3+268KJ
在密闭容器中达到平衡,下列说法中正确的是( )
(A)温度不变,缩小体积,ClF的转化率增大
(B)温度不变,增大体积,ClF3的产率提高
(C)升高温度,增大体积,有利于平衡向正反应方向移动
(D)降低温度,体积不变,F2的转化率提高
3、某合成氨反应在恒容容器中达平衡时,N2、H2、NH3的物质的量分别为a、3a、0.5a摩尔。
(1)再往容器中通入0.2摩尔N2、0.6摩尔H2、0.1摩尔NH3,平衡移动( )
(2)改加0.1摩尔N2、0.4摩尔H2、0.05摩尔NH3,平衡移动( )
(A)向正向 (B)向逆向 (C)不发生 (D)方向无法确定
4、反应N2O4 2NO2在恒容恒温密闭容器中达平衡。然后
(1)在容器中注入适量N2O4,气体颜色将( )
(2)或在容器中注入适量NO2,气体颜色将( )
(A)变浅 (B)变深 (C)不变 (D)先变浅再变深
5、一定量混合气体在密闭容器中发生如下反应:xA(气)+yB(气) zC(气),达平衡后测得气体的浓度为0.5摩/升。恒温下将容器扩大1倍,反应重新平衡,测得A浓度为0.25摩/升。下列叙述中正确的是( )
(A)x+y>z (B)平衡向右移动
(C)B的转化率提高 (D)C的体积百分含量降低
6、在C(s)+CO2(g) 2CO(g)-172kJ的平衡体系中,下列说法中错误的是( )
(A)减小压强,混合气体的平均分子的相对质量减小
(B)保持温度和混合气体总体积不变,加入一定量CO2,达到新平衡后,混合气体的平均分子的相对质量减小
(C)保持温度和气体体积不变的条件下,加入一定量N2,平衡不会移动
(D)向平衡体系中加入一定量CO2,并保持温度和压强不变,达到新的平衡后,混合气体的平均摩尔质量将增大
7、在一定条件下,把3molN2和3molH2通入一个一定容积的密闭容器中,发生如下反应:N2+3H3 2NH3,当此反应达到一定程度时,反应混合物就处于平衡状态,此时容器内气体的压强为 。若在上述完全相同的容器中,维持温度不变,通入1molNH3和________mol N2、________molH2,才能使容器内的压强仍为 。平衡时N2物质的量取值范围在________mol至________mol之间,NH3的量在_________mol至________mol之间。达到平衡时,H2和NH3均为1.5mol,你认为是否合理?(填可能、不可能)________
9、反应SO2(g)+NO2(g) NO(g)+SO3(g),在一定条件下达到平衡,再向容器中通入一定量O2,下列说法正确的是( )
(A)平衡向正反应方向移动,达到新平衡时容器内压强一定减小
(B)平衡向逆反应方向移动,容器内压强一定不增大
(C)平衡不移动,只增大容器内压强
(D)平衡向正反应方向移动,容器内压强不一定增大
10、一真空密闭容器中盛有amolPCl5,加热到200℃时发生如下反应:
PCl5(气) PCl3(气) +Cl2(气)
反应达平衡时,PCl5所占体积百分比为M%,若在同一温度和同一容器中,最初投入的是2amol PCl5,反应平衡时,PCl5所占体积百分比为N%,则M与N的关系是( )
(A)M>N (B)N>M (C)M=N (D)无法比较
11、有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混和气体,并使A和B容积相等(见下图)在保持400℃的条件下使之发生如下反应: 2SO2+O2 2SO3(气)
(1)达到平衡时所需的时间A容器比B容器____,A容器中SO2的转化率比B容器_____。
(2)达到(1)所述平衡后,若向两容器中通入等量的氩气,A容器化学平衡___移动,B容器化学平衡____移动
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到新平衡时:A容器中SO3的百分含量____(增大、减小、不变。下同),B容器中SO3的百分含量____。
12、在一密闭容器中充入1摩NO2,建立如下平衡:2NO2 N2O4,测得NO2的转化率为a%。在其它条件不变时,再充入1摩NO2,待新平衡建立时,又测得NO2的转化率为b%。推出a、b值的大小关系为_____,并简要加以证明____。
13、已知2NO2 N2O4+Q。将NO2充入容易导热的材料制成的容器a和b中进行反应。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。
当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反 应同时开始。
(1)反应开始时,a与b中生成N2O4的速度va_____vb
(2)反应过程中两容器里生成N2O4的速度是va_____vb
(3)达到平衡时,a与b中NO2转化为N2O4的百分数(A)相比较,则是Aa______Ab
14、已知有H2+I2(气) 2HI+Q可逆反应,今有两体积相等的密闭容器,在A中充有0.5摩H2和0.5摩I2(气)。B中充入2摩HI,在相同的温度下均达到平衡:
(a)A中压强是B的________。A中HI浓度是B的_______,反应速度A______B
(b)将A的温度升高,V正______,V逆_____混和气体颜色________,H2的转化率______混和气体平均分子量_______(变大、不变或变小)
(c)将B容器体积压缩1/4,混和气体颜色____,HI分解率_____,V正_______,V逆__________。
15、在固定容积的密闭容器中氮氢合成氨的反应达到了平衡,容器中含有0.1摩N2、0.3摩H2、0.1摩NH3,若维持原来的条件,向该容器中再同时加入0.1摩N2,0.3摩H2,0.1摩NH3,则( )
( A )正、逆反应速度同时增大,平衡不移动
( B )正、逆反应速度同时增大,NH3的百分含量升高
( C )正、逆反应速度同时增大,平衡向逆反应方向移动
( D )正、逆反应速度不变,平衡不移动
化学平衡(五)计算题
1、在一密闭容器中,充入5摩SO2和4摩O2,保持温度、体积不变,当反应达平衡时,压强为起始状态的7/9。求SO2转化率是多少?
2、在一定温度、压强和有催化剂存在条件下,将N2和H2按1:3的体积比混合,当反应达平衡时,混合气中含有mmol的N2,且NH3的体积分数量为a%,求起始时N2、H2的物质的量各是多少mol?
3、将6molH2和3molCO充入容积为0.5L的密闭容器中,进行如下反应:2H2(气)+CO(气) CH3OH(气),6s体系达平衡,此容器压强为开始时的0.6倍。试求:(1)H2的反应速率?(2)CO的转化率?
4、将等物质的量的A,B混合于2L的密闭容器中,发生反应
3A(气)+B(气) xC(气)+2D(气)。经5min后达到平衡时,测知D的浓度为0.5mol/L,[A]:[B]=3:5,C的平均反应速率为0.1mol/L·min。试求(1)A的平衡浓度是多少?(2)B的平均反应速率?(3)x=?
5、合成氨的反应在一定条件下达到平衡,测得体系中NH3为4mol,起始与平衡时的压强之比为13:8,且[H2]始:[H2]平=4:1,求N2和H2的转化率。
6、1体积SO2和3体积空气混合后在450℃以上通过V2O5催化剂发生反应。若同温同压下测得反应前后混合气体的密度比为0.9:1,求SO2的转化率。
7、在763K、3.04×104千帕时,用CO和H2作原料合成CH3OH,存在下列平衡:CO(气)+2H2(气) CH3OH(气)当原料中H2和CO的比例不同时,对CO的转化率及平衡混和物中甲醇的体积百分含量都有影响。
(1)设H2和CO的起始物质的量之比为n,平衡时CO的转化率为a,平衡混和物中甲醇的体积百分含量为y。试推断n、a、y三者的关系表达式为。
(2)将下表已知数据代入表达式中进行计算,把计算结果填入表中有关空格中:
n
a
y
1
0.25
(a)
2
0.45
(b)
3
19.35%
(3)根据上表数据,判断用CO和H2合成甲醇时,H2和CO的最佳体积比是多少?并简述选出的依据____。
8、合成氨反应在定温定压下进行,达平衡后温度和压强如初,氨占总体积的20%。求平衡时总体积与起始总体积之比?
9、接触法制硫酸中,焙烧黄铁矿所得气体含N278%、O211%、SO27%、CO24%,进入接触室后反应,气体体积变为原来的96.7%,求SO2的转化率及反应后O2和N2的体积比?
10、合成氨工厂常通过测定反应前后混合气体的密度来确定反应物的转化率。某工厂测得合成塔中N2、H2混合气体密度为0.554克/升(标况)从合成塔中出现的混合气体在相同条件下密度为0.693克/升。求该合成氨厂N2的转化率为多少?
11、某可逆反应A(气)+B(气) C(气),在两个完全相同密闭容器中分别加入A、B各1摩,第一个容器温度为400℃,达到平衡时压强为原来的75%,第二个容器温度为600℃,达到平衡时A的体积百分含量为25%,通过计算推断该反应的正反应是吸热反应还是放热反应?
12、在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(气)+B(气) x(气)+2D(气),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________; (2)B的平衡浓度为____________;
(3)A的转化率为________; (4)生成D的反应速率为____________;
(5)如果增大反应体系的压强,则平衡体系中C的质量分数________(填增大、减小或不变);
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入______物质____mol。
13、10℃时,0.1mol/LNa2S2O3溶液和0.1mol/L硫酸溶液等体积混合,4分钟后有浑浊,若温度每升高10℃,化学反应速率增大到原来的2倍,则温度升高到40℃时,____秒钟后即可出现浑浊。
14、把氮气和氢气以1:1物质的量比混匀后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空密闭容器中(容器的容积固定),在保持相同温度的条件下,四个容器中的合成氨反应相继达到化学平衡状态。分析表中实验数据后回答问题(用A、B、C、D填空):
容器代号
A
B
C
D
平衡时混合物的平均式量
16
17
平衡时N2的转化率
20%
平衡时H2的转化率
30%
(1)都达平衡时,____容器中NH3的物质的量所占比例最大
(2)达到平衡所需时间最长的容器代号是____。
(3)四个容器的容积由小到大的排列次序是____。
15、在一个x升的密闭容器中放入y升的A(气)和z升的B(气),在一定条件下发生下列反应:3A(气)+B(气) nC(气)+2D(气)。这平衡后,A的浓度减少1/2,混合气的平均相对分子质量比原气体增大1/8。式中n值(正整数)为_______
16、在一定条件下,测得2CO2 2CO+O2的平衡混合物的密度为M/22.4(g/L)(标准状况),求该条件下CO2的平衡转化率(用含M的代数式表示)________。
17、将固体NH4I置于密闭容器中,在某温度下发生下列反应:
NH4I(固) NH3(气)+HI(气)、2HI(气) H2(气)+I2(气)
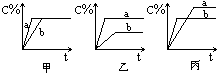
当反应达平衡时 [H2]=0.5mol/L,[NH3]= 5mol/L,则HI的浓度为________
18、在一定温度和压强下,将平均分子的相对质量为8.5N2和H2的混合气体,充入密闭容器中反应,达到平衡后,混合气体的平均分子的相对质量为10.0,则N2的转化率为____。
19、将N2和H2混和,使其在一定条件下发生反应并达到平衡。根据表中数据回答有关问题:
物 质
浓 度
N2
H2
NH3
起始(摩/升)
a
6
0
转化(摩/升)
b
c
d
平衡(摩/升)
1
e
3
(1)表中a=____, b=____, c=____, d=_____, e=____。
(2)若反应经3分钟达到平衡,则反应速度vN =_____。
(3)氮气的转化率是____。
(4)该体系的起始状态和平衡状态的压强比(体积、温度不变)是____。
20、10.0克硫铁矿粉末被充分煅烧后,把生成的SO2气体跟4.8克O2混合,并使其在一定条件下反应。反应混合物先用冰水冷却后得到8.0克无色晶体,剩余气体通入足量的氢硫酸中充分反应生成8.8克黄色沉淀物。求硫铁矿中含硫质量分数。
化学反应速率和化学平衡(六) 难点解析
【难点解析及例题分析】
1. 对于在固定容积的容器内进行的反应前后气体体积不变的反应,只要初始时加入的原料符合方程式的系数之比,则反应达到平衡时,各组分的体积百分含量恒定。但是指定物质的浓度不一定相同。
例1:在一定容积的密闭容器内,发生反应:H2+I2 2HI 。
① 若初始时加入1mol的HI,则反应达到平衡时,HI的体积百分含量为W%。
② 若初始时加入2mol的HI,则反应达到平衡时,HI的体积百分含量与W%相比 。
2. 在恒温、定容条件下,对于类似H2+I2 2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应,只要方程式的另一边的几种反应物质的物质的量与方程式的系数成正比,无论加入多少量的生成物(在方程式的这一侧只有这种物质);或只加入这种单一反应物质(如HI),而另几种反应物的量为0,都能使反应达到平衡时,各组分的体积百分含量恒定。
例2:在一个固定容积的密闭容器内,发生反应:3X+2Y xZ。若初始时加入3mol的X,2mol的Y,则反应达到平衡时,Z 的百分含量为W%;维持温度和容器的体积不变,若初始时加入的物质为0.6molX,0.4molY,0.8molZ,反应达到平衡时,Z的百分含量仍为W%。求x的值。
3. 对于在固定容积的容器内进行的反应前后气体体积改变的反应,如果反应达到平衡时,各组分的体积百分含量相同,则各指定物质的物质的量浓度相同。
例3:在一个真空固定体积的密闭容器内,充入10molN2和30molH2,发生合成氨反应:N2+3H2 2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
A、15mol 25% B、20mol 50% C、20mol 75% D、40mol 80%
4. 在恒温、定容条件下,对于类似H2+I2 2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应:
①如果不加入单一反应物(HI),而同时加入非单一反应物(例如加入H2和I2),如果这两次的反应物的量成比例,也能使各组分的体积百分含量恒定。
② 如果加入的物质在反应方程式的两侧都有,则把单一反应物按照方程式的系数比转化为方程式一侧的几种反应物,如果能使这些反应物经过配比转化后的物质的量几次成比例,则也能使各组分的体积百分含量恒定。
例4:在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br2 2HBr。已知加入1molH2和2molBr2 时,达到平衡状态生成amolHBr。在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号
起始状态(mol)
平衡时HBr 物质的量(mol)
H2
Br2
HBr
已知
1
2
0
a
①
2
4
0
②
1
0.5a
③
m
n(n≥2m)
例5:有两个起始体积相同的密闭容器A和B,A容器中有一个可自由移动的活塞,能使该容器内始终保持恒压,B容器为固定体积的容器。起始时向这两个容器内分别充入等量的体积比为2 : 1的SO2和O2的混合气体,并使A、B两容器的体积相等。在保持400℃的合成条件下,使如下反应:2SO2+O2 2SO3达到平衡。请回答:
(1)达到平衡所用的时间A容器比B容器 ,两容器中SO2的转化率A比B 。
(2)达到(1)所述的平衡后,若向两容器内通入等量的原反应混合气,则重新达到平衡后,A容器中SO3的百分含量 ;B容器中SO3的百分含量 (增大、减小、不变)。
5. 在温度、压强不变的条件下,只要投入的原料经过转化以后成比例,则容器内各组分的百分含量相同,各指定物质的物质的量浓度也相同。
一定温度下,在一个固定体积的密闭容器中进行可逆反应:mA+nB pC+qD。如果两次反应投入原料物质不同,而反应达到平衡时,指定物质的浓度相同,则经过配比转化后的原料不仅完全成比例,而且物质的量完全相同。
例6:温度一定,在一个密闭容器内,发生合成氨反应:N2+3H2 2NH3。若充入1molN2和3molH2,反应达到平衡时NH3的体积百分含量为W%。若改变开始时投入原料的量,加入amolN2,bmolH2,cmolNH3,反应达到平衡时,NH3的体积百分含量仍为W%,则:
① 若温度、容器体积恒定a=b=0, c=
若温度、压强恒定a=b=0, c
② 若温度、容器体积恒定a=0.75, b= , c=
若温度、压强恒定a=0.75, b , c
③ 若温度、压强恒定,则 a、b、c之间必须满足的关系是
例7:保持恒温恒压,向容积可变的密闭容器中充入3LA和2LB,发生如下可逆反应:
3A(气) + 2B(气) xC(气) + yD(气)。 达到平衡后,C 的体积分数为m% 。若维持温度和压强不变,将0.6LA,0.4LB,4LC,0.8LD作为起始物质充入该密闭容器,达到平衡时使C的体积分数仍为m%。请回答:能否计算出x、 y的值,如果可以,请写出计算过程;如果不能,请说明理由,并写出x y应满足的等量关系。
例8:如图,一定温度下,把2体积N2和6体积H2通
入一个带有活塞的体积可变的容器内,活塞的一端与大 2体积N2 大气
气相通。容器中发生以下反应:N2+3H2 2NH3。当 和6体积H2
反应达到平衡时,测得混合物的体积为7体积。
请回答以下问题:
(1)保持上述反应温度不变,设a、b、c分别代表初始时的N2、H2和NH3的体积,反应达到平衡时,混合气体中各物质的百分含量与上述平衡相同。
①若a=1, c=2则b= 。在此情况下,反应起始时将向 方向移动。
② 若规定起始时反应向逆反应方向进行,则此情况下c 的取值范围是 。
(2)在上述装置中,若控制反应达到平衡时混合气体的体积是6.5体积,则可采取的措施是 ,原因是 。
来自: 中基网>>备课素材
 爱华网
爱华网



