1. 盐析与沉淀的关系
沉淀定义:
从溶液中释出的难溶解的固体物质。物体在液体中时,因自身重量和密度的关系沉积到容器底部。从液相中产生一个可分离的固相的过程,或是从过饱和溶液中析出的难溶物质。沉淀作用表示一个新的凝结相的形成过程,或由于加入沉淀剂使某些离子成为难溶化合物而沉积的过程。产生沉淀的化学反应称为沉淀反应。物质的沉淀和溶解是一个平衡过程,通常用溶度积常数Ksp来判断难溶盐是沉淀还是溶解。溶度积常数是指在一定温度下,在难溶电解质的饱和溶液中,组成沉淀的各离子浓度的乘积为一常数。分析化学中经常利用这一关系,借加入同离子而使沉淀溶解度降低,使残留在溶液中的被测组分小到可以忽略的程度。
沉淀特点
应用范围
沉淀分类
沉淀法
知识点:盐析法,等电点沉淀法,有机溶剂沉淀法,选择性变性沉淀法,金属离子沉淀法。
重点:上述几种沉淀方法的概念、原理及其适用范围;盐析法的影响因素对析出效果的影响,并能根据实际情况予以灵活应用和选择。
难点:常用沉淀方法的灵活运用。
沉淀法分类
• 盐析法
• 有机溶剂沉淀法
• 选择性变性沉淀法
• 等电点沉淀法
• 离子型聚合物沉淀法
• 聚电解质沉淀法
• 高价金属离子沉淀法
蛋白质理化性质
• 活性蛋白
• 非活性蛋白
• 理化性质
• 溶解度
• 提取方法
• 蛋白质溶液是一稳定的亲水性溶胶液,其稳定的因素有二:
• 一是蛋白质胶粒上的电荷使之相互排斥,不易凝集成团;
• 二是胶粒表面的水化膜,它使胶粒与水融洽相依,又在胶粒之间起了隔离作用。
• 如果上述两种稳定蛋白质溶液的因素被破坏,蛋白质将于溶液中析出,可通过离心收集沉淀。
• 促使蛋白质沉淀的因素很多,大致可分为两类:
沉淀反应
• 第一类是可逆的沉淀反应。
•这时蛋白质的空间构象未受到很大改变,除去沉淀因素后,可以重新溶解,例如盐析和低温乙醇沉淀蛋白。
• 乙醇是脱水剂,可与蛋白质争夺水化膜中水分子;
• 此外,加入乙醇可使水的介电常数变小,蛋白质解离度降低,带电量减少。故加入乙醇能破坏蛋白质的胶体性质而使蛋白质沉淀。
• 用此法在低温下操作可使沉出的蛋白质保持其理化特性及其生物学活性,
• 但室温中乙醇与蛋白质接触较久后,可使之变性,形成不可逆的沉淀
• 第二类是不可逆的沉淀反应,
• 重金属盐类或生物碱试剂沉淀蛋白后,由于蛋白质结构发生重大改变,所以不再溶于水中。
• 不可逆的蛋白质沉淀,多表示蛋白质已经变性。
• 蛋白质在加热时变性,蛋白质分子间相互盘绕而变成坚实的凝块。
上图的文字内容有错!
盐析
向蛋白质溶液中加入高浓度的中性盐,以破坏蛋白质的胶体性质,使蛋白质的溶解度降低, 而从溶液中析出的现象称为盐析。
如利用盐析法结晶肌红蛋白。
分段盐析
由于不同的蛋白质其溶解度与等电点不同,沉淀时所需的pH值与离子强度也不相同,改变盐的浓度与溶液的pH值,可将混合液中的蛋白质分批盐析分开,这种分离蛋白质的方法称为分段盐析法(fractionalsalting out)。如半饱和硫酸铵可沉淀血浆球蛋白,饱和硫酸铵则可沉淀包括血浆清蛋白在内的全部蛋白质。
盐析中常用的中性盐
硫酸铵、硫酸钠、氯化钠等,其中以硫酸铵最为常用。
盐析的原理:
破坏了蛋白质在水中稳定存在的二个因素,从而使蛋白质发生沉淀破坏了水化层
在高浓度的中性盐溶液中,由于盐离子亲水性比蛋白质强,与蛋白质胶粒争夺与水结合,破坏了蛋白质的水化层。
破坏了电荷
由于盐是强电解质,解离作用强,盐的解离可抑制蛋白质弱电解质的解离,使蛋白质带电荷减少。
盐析的机理
①把中性盐加入蛋白质溶液,中性盐对水分子的亲和力大于蛋白质,盐离子与蛋白质分子争夺水分子,降低了用于溶解蛋白质的有效水量,减弱了蛋白质的水合程度,破坏了蛋白表面的水化膜,导致蛋白质溶解度下降;于是蛋白质分子周围的水化膜层减弱乃至消失。
②同时,中性盐加入蛋白质溶液后,由于离子强度发生改变,蛋白质表面电荷大量被中和,更加导致蛋白溶解度降低,使蛋白质分子之间聚集而沉淀
③盐离子引起原本在蛋白质分子周围有序排列的水分子的极化,使水活度降低。
由于蛋白质的组成及性质不同,所以盐析时所需中性盐的浓度也不相同。
盐析原理
一般是指溶液中加入无机盐类而使溶解的物质析出的过程。如:加浓(NH4)2SO4使蛋白质凝聚的过程。
蛋白质在水溶液中的溶解度是由蛋白质周围亲水基团与水形成水化膜的程度,以及蛋白质分子带有电荷的情况决定的。当用中性盐加入蛋白质溶液,中性盐对水分子的亲和力大于蛋白质,于是蛋白质分子周围的水化膜层减弱乃至消失。同时,中性盐加入蛋白质溶液后,由于离子强度发生改变,蛋白质表面电荷大量被中和,更加导致蛋白溶解度降低,使蛋白质分子之间聚集而沉淀。
图碳氧血红蛋白的溶解度与硫酸铵离子强度的关系图
Ks盐析和β盐析
• Ks盐析:在一定的pH值及温度条件下,改变盐的浓度(即离子强度)达到沉淀的目的,称为“Ks”分级盐析法。
• (Ks盐析:固定pH, 温度,改变盐浓度)
•
• β盐析:在一定的离子强度下,改变溶液的pH值及温度,达到沉淀的目的,称为“β”分级盐析法。
(β盐析:固定离子强度,改变pH及温度)
• 二次盐析(分段盐析):
• 在原盐浓度下,可除去难溶杂质,但不能除去易溶杂质,所以需要进行更高盐浓度的第二次盐析
• 适用于目的蛋白的溶解性,高于 “易溶杂质”的场合。
• 可使用的中性盐有:
• (NH4)2SO4 , Na2SO4 , MgSO4, NaCl
• NaAc,Na3PO4 ,柠檬酸钠,硫氰化钾等
• 以(NH4) 2SO4, Na2SO4使用最广泛,
• 前者最受欢迎
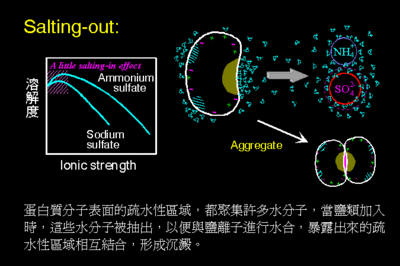
图 不同盐溶液中碳氧血红蛋白的溶解度与离子强度的关系(25℃)
(○)NaCl;(▼)KCl;(◐)MgSO4;(▲)(NH4)SO4;
(●)Na2SO4;(□)K2SO4; (■)柠檬酸三钠
• 盐析范围的确定,可采用盐浓度对蛋白质沉淀量的盐析曲线测得.
• 从回收率和纯度考虑
• 合适盐析范围的选择:
不同Pr盐析峰有重叠,须权衡纯度与回收率.
盐析影响因素
• 对β影响
• 对Ks影响
• 盐种类
• 盐浓度
• 温度
• pH值
• ① 蛋白质的浓度:
•中性盐沉淀蛋白质时,溶液中蛋白质的现实浓度对分离的效果有较大的影响。通常高浓度的蛋白质用稍低的硫酸铵达到最高限度便可将其沉淀下来,但若蛋白质浓度过高,则易产生各类蛋白质的共沉淀作用,除杂蛋白的效果会明显下降。
蛋白起始浓度效应
• 对低浓度的蛋白质,要使用更大的硫酸铵浓度,达到最高限度,但共沉淀作用小,分离纯化效果较好,但收受接管率会降低。
通常以为比较适中的蛋白质浓度是2.5%~3.0%,相当于25 mg/mL~30mg/mL。
• ② pH值对盐析的影响:
• 蛋白质所带净电荷越多,它的溶解度就越大。改变pH值可改变蛋白质的带电性质,因而就改变了蛋白质的溶解度。
不同蛋白质的溶解度曲线
不同蛋白质的盐析分布曲线
远离等电点处溶解度大,在等电点处溶解度小,因此用中性盐沉淀蛋白质时,pH值常选在该蛋白质的等电点附近。
pH值对β盐析的影响
• ③ 温度的影响:
• 温度是影响溶解度的重要因素,对于多数无机物质的盐类和小分子有机物,温度升高溶解度加大,
• 但对于蛋白质、酶和多肽等生物大分子,在高离子强度溶液中,温度升高,它们的溶解度反而减小。
• 在低离子强度溶液或者纯水中蛋白质的溶解度,大多数还是随浓度升高而增加的。
• 在一般情况下,对蛋白质盐析的温度要求不严格,可在室温下进行。
但对于某些对温度敏感的酶,要求在0℃~4℃操作,以避免活力丧失。
蛋白含量曲线(a)和盐析分布曲线(b)
沉淀曲线
•硫酸铵浓溶液的PH常在4.5~5.5之间,市售的硫酸铵还常含有少量游离硫酸,PH值往往降至4.5以下,当用其他PH值进行盐析时,需用硫酸或氨水调节。
• 确定沉淀蛋白质所需硫酸铵浓度的方法
•将少量样品冷却到0~5℃,然后搅拌加入固体硫酸铵粉末,见蛋白质产生沉淀时,离心除去沉淀,分析上清液,确定所要蛋白质的浓度。
• 如它仍在溶液中则弃去沉淀,再加更多的硫酸铵于上清液中,直到产生目的蛋白质沉淀时止。
•以所要提取的蛋白质在溶液中的浓度对硫酸铵浓度作图,得沉淀曲线,找出蛋白质开始沉淀的浓度。如不考虑收率,饱和度区间可取得窄一些,使纯度高一些。
盐析曲线的制作
• 如果要分离一种新的蛋白质和酶,没有文献数据可以借鉴,则应先确定沉淀该物质的硫酸铵达到最高限度。具体操作方法如下:
•取已经定量测定蛋白质或者酶的活性与浓度的待分离样品溶液,冷至0℃~5℃,调至该蛋白质稳定的pH值,分6~10次分别加入不同量的硫酸铵,第一次加硫酸铵至蛋白质溶液刚开始出现沉淀时,记下所加硫酸铵的量,这是盐析曲线的出发点。
•继续加硫酸铵至溶液微微混浊时,静止一段时间,离心得到第一个沉淀级分,然后取上清再加至混浊,离心得到第二个级分,如此连续可得到6~10个级分,按照每次加入硫酸铵的量,在附录中查出相应的硫酸铵达到最高限度。
• 将每一级分沉淀物分别溶解在一定体积的适宜的pH缓冲液中,测定其蛋白质含量和酶活力。
• 以每个级分的蛋白质含量和酶活力对硫酸铵达到最高限度作图,便可得到盐析曲线。
盐的加入方式(四种)
• 1.加入固体盐法,
• 用于要求饱和度较高而不增大溶液体积的情况;固体研细后缓慢加入,防泡沫,要平衡.
• 2.加入饱和溶液法,
• 用于要求饱和度不高而原来溶液体积不大的情况;使用饱和盐溶液,要求盐析范围小于50%饱和度
• 3. 透析盐析.
•属于透析平衡法,先将盐析的Pr溶液样品装于透析袋中,然后放入一定浓度的盐溶液中,或浸入饱和硫酸铵中进行透析,由于渗透压的作用,透析袋内硫酸铵饱和度逐渐提高,达到设定浓度后,目的蛋白析出,停止透析。
• 该法优点在于硫酸铵浓度变化有连续性,盐析效果好,但手续繁琐,需不断测量饱和度,故多用于结晶,其它情况少见。
• 4. 反抽提法(Back-Extraction) .
反抽提法将包括要分离的Pr在内的多种Pr一起沉淀出来 , 然后选择适当的递减浓度的硫酸铵来抽提沉淀物.
一. 固体法
欲从较大体积的粗提出取得液中沉淀蛋白质时,往往使用固体硫酸铵,加入之前要先将其研成齑粉不能有块,要在搅拌下缓慢均匀少量多次地加入,尤其到接近计划达到最高限度时,加盐的速度更要慢一些,尽量避免局部硫酸铵浓度过大而造成不应有的蛋白质沉淀。
•按照盐析表中的数据去做,从低浓度的饱和度开始,每做完一个饱和度后离心,沉淀即为一种类型的蛋白,然后向上清中再加硫酸铵到下一个饱和度。
• 依此类推。虽然很麻烦,但可以将不同的蛋白质分开。
• 使用固体硫酸铵时:
• 必须注意饱和度表中规定的温度,一般有0℃、20度或室温三种,加入固体盐后体积的变化,在表中已考虑;
•各类达到最高限度下需加固体硫酸铵的量可由附录中查出。硫酸铵浓度的表示方法是以达到最高限度溶液的百分数表示,称为百分达到最高限度,而不用现实的克数或者克分子数,这是因为当固体硫酸铵加到水溶液中去时,会出现相当大的非线性体积变化,计算浓度相当麻烦。
•为了克服这一困难,有人经过精心测量,确定出1升纯水提高到不同浓度所需加入硫酸铵的量,附录中的实验数据以达到最高限度浓度的百分数表示,使用时十分便利。
• 0度: 707,706, 697,679,676,515,505
• 15度:640g/L
• 20度:760,756,754,537, 534 g/L
• 25度: 767,541 g/L
以下是不同版本的饱和度表,数据有差别。
760克达到饱和:
760克达到饱和:
X是将一升饱和度为S1的溶液,提高到饱和度为S2的溶液时,要加的固体硫酸铵的克数。 S1和S2,用小数。
•X= G (S2-S1) / (1-A S2)
•_____________________
•GA
•_____________________
•0度,7070.27
• 20度,7560.29
• _____________________
二.加饱和硫酸铵溶液法
进行沉淀操作时,欲使溶液到达一定的硫酸铵浓度,需要加入的硫酸铵溶液的浓度和体积可按下式计算:
V = V0 (S2 -S1) /(100-S2)
式中:
V = 需加入100%饱和度硫酸铵溶液的体积
V0 = 原溶液体积
S1 = 原溶液中硫酸铵溶液的饱和度,用整数
S2 = 所要求到达的硫酸铵溶液的饱和度,用整数
100是指加入的硫酸铵溶液饱和度为100%
• 盐析后一般放置半小时至一小时,待沉淀完全后才过滤或离心。
•过滤,多用于高浓度硫酸铵溶液,因为此种情况下,硫酸铵密度较大,若用离心法需要较高离心速度和长时间的离心操作,耗时耗能。
•离心,多用于低浓度硫酸铵溶液。
盐析后要在冰浴中放置一段时间(盐也会析出,影响后续饱和度),待沉淀完全后再离心与过滤。
盐析的优缺点
1. 成本低,不需要特别昂贵的设备。
2. 操作简单、安全。
3. 不会引起蛋白质变性,经透析去盐后,能得到保持生物活性的纯化蛋白质。
4. 效果不理想,通常只是作为初步的分离纯化,还需要结合其它的纯化方法。
注意事项
盐析的成败决定于溶液的pH值与离子强度,溶液pH值越接近蛋白的等电点,蛋白质越溶液沉淀。
盐析的应用---分离蛋白质分子
2. 盐析沉淀实验操作
• 盐析沉淀步骤
• 加沉淀剂的四种方式
• 沉淀条件
• 脱盐处理
蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵,由下表可以看出:它的优点是温度系数小而溶解度大(20度时饱和溶液为754克/升;0度时饱和溶解度为706克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。
表1 几种盐在不同温度下的溶解度(克/100毫升水),
0℃20℃80℃100 ℃
(NH4)2SO470.675.495.3103
Na2SO44.918.943.342.2
NaH2PO41.67.893.8 101
饱和硫酸铵法操作
1. 取xml血清加x ml生理盐水,于搅拌下逐滴加入2xml饱和硫酸铵,硫酸铵的终饱和度为50%。
2.4℃,3h以上,使其充分沉淀离心(3000rpm),20min,充上清,以xml生理盐水溶解沉淀,再逐滴加饱和硫酸铵x/2ml。置4℃3h以上,[此时,(NH4)2SO4的饱和度为33%]重复上述第二步过程1~2次。末次离心后所得沉淀物为蛋白,以0.02%mol/LpH7.4PBS溶解至xml装入透析袋。对PBS充分透析、换液3次,至萘氏试剂测透析外液无黄色,即无NH4+为止。蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入透析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。取透析袋内样品少许作适当倍数稀释后,以紫外分光光度计测定蛋白含量。
方法如下:蛋白含量(mg/ml)=(1.45×OD280nm-0.74×OD260nm)×样品稀释度。
注:式中1.45与0.74为常数,nm为波长
分段盐析操作
对分离目的蛋白的盐析,最好采用分段盐析。由于不同的蛋白质其溶解度与等电点不同,沉淀时所需的pH值与离子强度也不相同,改变盐的浓度与溶液的pH值,可将混合液中的蛋白质分批盐析分开,这种分离蛋白质的方法称为分段盐析法(fractionalsaltingout)。如半饱和硫酸铵可沉淀血浆球蛋白,饱和硫酸铵则可沉淀包括血浆清蛋白在内的全部蛋白质。
1.分段盐析的条件先需要进行小实验探索,如:先进行0%-30%的硫酸铵沉淀,再进行30%-60%的硫酸铵沉淀,最后进行60%-80%的硫酸铵沉淀。基因酷基因库
2.每一段盐析静置之后都将离心取沉淀,透析并检测活性。通过实验结果可以看出哪一段盐析出来的目的产物最多,相对来说杂质就更少。
3.比如实验中的活性物质主要在60%-80%这段出来,在以后的实验中,就可以首先进行0%-60%的硫酸铵沉淀,这段沉淀物可以抛弃(去处大多数杂质);然后进行60%-80%的硫酸铵沉淀,这段沉淀出来是物质是所需要的目的物质含量比较高的物质,将其收集进行下一步纯化工作。
盐析曲线的制作
如果要分离一种新的蛋白质和酶,没有文献数据可以借鉴,则应先确定沉淀该物质的硫酸铵饱和度。具体操作方法如下:
取已定量测定蛋白质或酶的活性与浓度的待分离样品溶液,冷至0℃~5℃,调至该蛋白质稳定的pH值,分6~10次分别加入不同量的硫酸铵,第一次加硫酸铵至蛋白质溶液刚开始出现沉淀时,记下所加硫酸铵的量,这是盐析曲线的起点。继续加硫酸铵至溶液微微混浊时,静止一段时间,离心得到第一个沉淀级分,然后取上清再加至混浊,离心得到第二个级分,如此连续可得到6~10个级分,按照每次加入硫酸铵的量,查出相应的硫酸铵饱和度。将每一级分沉淀物分别溶解在一定体积的适宜的pH缓冲液中,测定其蛋白质含量和酶活力。以每个级分的蛋白质含量和酶活力对硫酸铵饱和度作图,即可得到盐析曲线。
盐析注意事项
1. 盐析的成败决定于溶液的pH值与离子强度,溶液pH值越接近蛋白的等电点,蛋白质越容易沉淀。
2. 盐析一般用的硫酸铵,容易吸潮,因而在使用前,一般先磨碎,平铺 放 入烤箱内60摄氏度烘干后再称量,这样更准确。
3.在加入盐时应该缓慢均匀,搅拌也要缓慢,越到后来速度应该更注意缓慢,如果出现一些未溶解的盐,应该等其完全溶解后再加盐,以免引起局部的盐浓度过高,导致酶失活。
4. 盐析后最好搅拌40分钟到一个小时而且再在冰浴中放置一段时间。3.5为了避免盐对酶的影响,一般脱盐处理后再测酶活性。
5. 盐析后的蛋白质最好尽快脱盐处理,以免变性,透析较慢,一般可用超滤或者G-25,G-50 处理。6.一般粗提物蛋白完全沉淀是在硫酸铵浓度在70%左右。
影响盐析的因素
1. 蛋白质的浓度:
中性盐沉淀蛋白质时,溶液中蛋白质的实际浓度对分离的效果有较大的影响。通常高浓度的蛋白质用稍低的硫酸铵饱和度即可将其沉淀下来,但若蛋白质浓度过高,则易产生各种蛋白质的共沉淀作用,除杂蛋白的效果会明显下降。对低浓度的蛋白质,要使用更大的硫酸铵饱和度,但共沉淀作用小,分离纯化效果较好,但回收率会降低。通常认为比较适中的蛋白质浓度是2.5%~3.0%,相当于25mg/mL~30mg/mL。
2. 离子强度:各种蛋白质的沉淀要求不同的离子强度。
3. 盐的性质:最有效的盐是多电荷阴离子。
4.PH值:一般说来,蛋白质所带净电荷越多,它的溶解度就越大。改变pH值可改变蛋白质的带电性质,因而就改变了蛋白质的溶解度。远离等电点处溶解度大,在等电点处溶解度小,因此用中性盐沉淀蛋白质时,pH值常选在该蛋白质的等电点附近。
5.温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。蛋白质沉淀后宜在4℃放3小时以上或过夜,以形成较大沉淀而易于分离。盐析时,分子量较小的蛋白质逐步沉淀下来可能就值得怀疑。具体的蛋白需要具体的摸索,当然,对肽来说,结论也是一样的。
盐析法应用
1. 免疫球蛋白和酶提取、分离纯化、浓缩等。
2. 中药的提取
盐析法是在中草药的水提液中、加入无机盐至一定浓度,或达到饱和状态,可使某些成分在水中的溶解度降低沉淀析出,而与水溶性大的杂质分离。例如三七的水提取液中加硫酸镁至饱和状态,三七皂甙乙即可沉淀析出,自黄藤中提取掌叶防己碱,自三颗针中提取小檗碱在生产上都是用氯化钠或硫酸按盐析制备。有些成分如原白头翁素、麻黄碱、苦参碱等水溶性较大,在提取时,亦往往先在水提取液中加入一定量的食盐,再用有机溶剂萃取。
盐析常见问题分析
1.硫酸铵沉淀到底能否把蛋白按分子量分开?
硫酸铵沉淀的机理其实就是盐析(saltout)。一般而言蛋白质在溶液里面溶解度和盐浓度有关系。在低盐浓度下,如果增加盐浓度,会增强蛋白质的溶解,这是因为,盐的离子与蛋白质表面的正负电荷配对,减少了蛋白质电荷表面相互作用的机会。
当盐浓度高到一定程度的时候,过多的盐会跟蛋白质疏水表面争夺水分子,以至于蛋白质疏水表面倾向于相互作用形成聚合物沉淀下来。相对来说,分子量大的蛋白质量比较容易发生沉淀,但实际上影响因素很多,比如溶液PH,蛋白浓度,有无非蛋白质成分等,而分子量只是众多影响因素之一。
因此,想根据蛋白质分子量的不同利用硫酸氨沉淀将其分开,不是可取的方法。
盐析法是利用抗体与杂质蛋白对盐浓度的敏感程度的差异来进行分离。实际上就是利用溶解度的差异进行分离。拿抗体溶液来说,当硫酸铵饱和溶液达到20%时,纤维蛋白首先析出,当28%-33%大部分优球蛋白析出,当33%-50%时球蛋白析出,大于50%其他杂蛋白析出。从这几种蛋白的析出顺序看,好像与蛋白的分子量有一定的关系,优球蛋白分子量达到上千亿,球蛋白(IgG)十几万,分子量相差太悬殊了,从化学的角度看,对于同数量级别的分子来说,其溶解度与分子量是没有太大关系的。所以想把不同分子量的蛋白分离开比较费劲。
2.酶在盐析时上清和沉淀中酶活差不多一样高;在与酶等电点相同的缓冲液中透析24hrs后,酶活基本丧失;还有,对透析后的沉淀用提取液溶解,有不溶物,为什么?缓冲液pH选的对不?沉淀是用提取液溶解吗?
酶在盐析时上清和沉淀中酶活差不多一样高,说明盐浓度不够,应增加盐的浓度,使酶大部分沉淀下来,直到上清中检测不到该酶为止。或者考虑一下过高的盐离子会不会影响酶活测定。
盐浓度越高,对蛋白质活性的影响越大,也会有越多的不溶蛋白质(当然也包括杂蛋白和其他杂质),这是计算收率时需要考虑的。缓冲液的ph值和体积也会影响蛋白质的溶解度。酶在等电点最易沉淀,应选离等电点较远的缓冲液进行透析,而且要保证缓冲液的pH值在该酶的稳定pH范围内,这样才不易使酶失活。
盐析沉淀的蛋白质最好立即进行脱盐处理(超滤或者G25),透析好像太慢了,特别是对于酶}。沉淀用提取液溶解是可行的,但是选的提取液必须要是正确的才行,即能够提出目的酶!酶的透析也可在提取液中进行!
3.盐析用盐的Ks值顺序是硫酸钠>硫酸铵,可是又在盐析感胶离子序中写到钠离子>铵离子,这是怎么回事呢?
Ks值与两个因素有关,一个是盐的性质,包括盐离子的离子价数和半径;一个是与蛋白质的性质有关,还与温度、pH值有关。所以感胶系数是单谈离子性质,而Ks就广泛多了。公式:Ks=lgS/(beta*I),其中S 是在离子强度为 I 时该蛋白的溶解度。beta是在纯水中该蛋白的溶解度,在一定温度和pH值下是常数。
4.如何使沉淀更加完全?
沉淀要想比较完全,那需要在低温下放一段时间,只有这样那些小的沉淀才会很好聚集而上面的完全澄清,此外这也和浓度有关,浓度低些这样的现象更明显,沉淀后放4度过夜,那沉淀应该更完全了。
在查阅文献的时候,看到有关cohn公式的一个观点.:
若目的Pr的浓度较高, 且Pr种类不多时, cohn公式适用; 若目的Pr浓度低,且Pr种类多时, 则不适用.
蛋白质溶于水,有两个原因,一是蛋白质外层水膜,二是电荷,盐析从本质上说,是加入盐使蛋白质的水化层破坏,疏水基暴露,电荷中和而沉淀,若目的Pr的浓度较低,,总有一部分盐是在溶液中呈游离的离子状态,这部分盐是不起上面的作用的,而多种蛋白是一种蛋白的综合,故不适用。
在盛有鸡蛋白溶液的试管里,缓慢地加入饱和(NH4)2SO4或Na2SO4溶液,观察沉淀的析出。然后把少量带有沉淀的液体加入盛有蒸馏水的试管里,观察沉淀是否溶解。
向蛋白质溶液中加入某些浓的无机盐[如(NH4)2SO4或Na2SO4]溶液后,可以使蛋白质凝聚而从溶液中析出,这种作用叫做盐析。这样析出的蛋白质仍可以溶解在水中,而不影响原来蛋白质的性质。因此,盐析是一个可逆的过程。利用这个性质,可以采用多次盐析的方法来分离、提纯蛋白质。
蛋白质盐析实验成功的关键
(一)试剂配制要求
1.蛋白质的配制。取一个鲜鸡蛋的蛋白置于装有50mL蒸馏水的烧杯中,用玻璃棒搅拌,让鸡蛋白充分溶解,再用双层纱布过滤鸡蛋白液,滤液待用。
2.对电解质的要求。做蛋白质盐析实验时,要保持蛋白质的活性,因此选用的电解质必须是一些轻金属盐、铵盐等。
经过实验,能使鸡蛋白从其水溶液中沉淀析出,且现象明显,对电解质溶液有两方面的要求:
(1)电解质溶液较浓,最好达到饱和;
(2)电解质溶液pH在1~3之间。
(二)操作过程及实验效果
取3 []mL~4mL鸡蛋白液于试管中,用滴管取上述电解质中的一种,沿试管壁慢慢加入1 mL~2mL,不要振荡,很快就可以看到试管中有白色沉淀析出。在该试管中,加入少量蒸馏水,振荡,溶液又变回原状,白色絮状物质又溶解。再滴入电解质溶解,还可以形成沉淀,这样就可以反复做二、三次。
 爱华网
爱华网