第三节 物质的量浓度
【教学目标】
1.使学生理解物质的量浓度的概念。
2.使学生掌握有关物质的量浓度的计算。
3.使学生掌握一定物质的量浓度的溶液加水稀释的计算。
4.掌握物质的量浓度与溶质质量分数的换算。
5.使学生初步学会配制一定物质的量浓度溶液的方法和技能,学会容量瓶的使用方法。
【教学重点】
1.物质的量浓度的概念。
2.有关物质的量浓度概念的计算。
3.溶液中溶质的质量分数与物质的量浓度的换算。
4.一定物质的量浓度的溶液的配制方法。
【教学难点】
正确配制一定物质的量浓度的溶液。
【教学方法】
讲解、比较、练习、实验、归纳等。
【课时安排】
第一课时:物质的量浓度的概念及其运算。
第二课时:一定物质的量浓度溶液加水稀释的计算与物质的量浓度与溶质质量分数的换算。
第三课时:配制一定物质的量浓度溶液的方法和技能。
【教具准备】
投影仪。
容量瓶(500 mL)、烧杯、玻璃棒、胶头滴管、药匙、托盘天平、滤纸、Na2CO3固体、蒸馏水。
【教学过程】
第一课时
[引言]在生产和科学实验中,我们经常要使用溶液。溶液的浓稀程度我们用浓度来表示。表示溶液浓度的方法有多种,在初中,我们学过的溶液的溶质质量分数便是其中的一种。今天,我们来学习另一种表示溶液浓度的物理量——物质的量浓度。
[板书]第一节物质的量浓度(第一课时)
一、物质的量浓度
[问]什么是物质的量浓度呢?请大家阅读课本55页第一部分内容“物质的量浓度”后回答。
[学生阅读,总结]
[师]请大家用准确的语言叙述物质的量浓度的概念,并说出它的符号是什么?
[学生回答,教师板书]
以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:c(B)
[问]B的含义是什么?
[生]B表示溶液中所含溶质。
[师]对!其不但表示溶液中所含溶质的分子,还可表示溶液中所含溶质电离出的离子。
[问]物质的量浓度的概念,我们也可以简化为一个代数式,怎样表示?
[生]物质的量浓度c(B)等于溶液中所含溶质B的物质的量n(B)与溶液的体积V的比值。
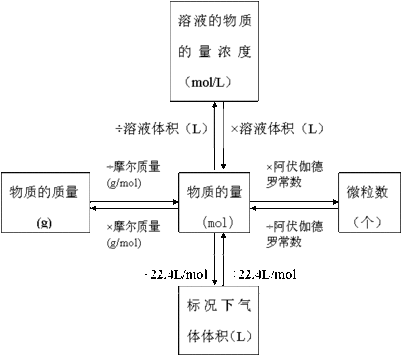
[板书]c(B)=n(B)/V(液)
[问]能从上式得出物质的量浓度的单位吗?
[生]能!是摩尔每升或摩尔每立方米。
[板书]单位:mol/L(或mol/m3)
[师]在中学化学中,我们最常用的单位是摩尔每升。
[过渡]下面,我们根据物质的量浓度的概念来进行一些计算。
[板书]1.将28.4 gNa2SO4溶于水配成250 mL溶液,计算溶液中溶质的物质的量浓度,并求出溶液中Na+和SO42- 的物质的量浓度。
[师]请大家用规范的解题格式解答此题。
[学生活动,教师巡视,同时请一位同学上黑板解答此题]
[学生板书]
解:n(Na2SO4)=m(Na2SO4)/M(Na2SO4)=28.4g/142g·mol-1=0.2 mol
c(Na2SO4)=n(Na2SO4)/V(液)=0.2 mol/0.25L =0.8mol·L-1
因为Na2SO4====2Na++SO42-
故溶液中n(Na+)=2n(Na2SO4)=2×0.2 mol=0.4 mol
n(SO42-)=n(Na2SO4)=0.2mol
则c(Na+)=n(Na+)/V(液)=0.4 mol /0.25L=1.6mol·L-1;
c(SO42-)=n(SO42-)/V(液)=0.2 mol /0.25L =0.8mol·L-1。
答:所配溶液中溶质的物质的量浓度为0.8 mol·L-1,Na+和SO42-的物质的量浓度分别为1.6 mol·L-1和0.8 mol·L-1。
[师]大家做得都很好,需要注意的是解题过程的规范化。
从上题的解答我们知道,利用物质的量浓度的概念,我们既可求出溶液中所含溶质的物质的量浓度,也可求出溶液中的离子的物质的量浓度,只不过求溶液中离子浓度时,n(B)为所求离子的物质的量。
另外,表示某物质的水溶液时,我们常用aq来进行标注,如上题中的Na2SO4溶液的体积,我们用符号V[Na2SO4(aq)]表示,以区别纯的Na2SO4固体的体积V(Na2SO4)。
[板书,把上题中的V(液)改为V[Na2SO4(aq)]]
[师]请大家再做下面的练习:
[投影]配制500 mL 0.1 mol·L-1的NaOH溶液,需NaOH的物质的量是多少?质量是多少?
[学生活动,教师巡视]
[师]此题反映的是溶液体积、溶质质量、溶质的物质的量及溶质的物质的量浓度之间的换算,只要熟悉各量之间的关系,此种类型的题便可轻易得解。
本题的解答过程如下,供大家思考。
[投影]解:依题意
n(NaOH)=c(NaOH)·V[NaOH(aq)]=0.1 mol·L-1×0.5 L=0.05 mol;
0.05 mol NaOH的质量:
m(NaOH)=n(NaOH)·M(NaOH)=0.05 mol×40 g·mol-1=2 g。
答:配制500 mL 0.1 mol的NaOH溶液需NaOH的物质的量为0.05 mol,质量为2 g。
[师]请大家思考并回答下列问题:
[投影]1.将342 gC12H22O11(蔗糖,相对分子质量为342)溶解在1 L水中,所得的溶液中溶质的物质的量浓度是否为1 mol·L-1?为什么?
2.从1 L 1 mol·L-1的C12H22O11溶液中取出100 mL, 取出的溶液中C12H22O11的物质的量浓度是多少?怎么得出来?
[学生思考后回答]
1.将342 g蔗糖溶解在1 L水中,所得溶液的物质的量浓度不为1 mol·L-1。因为342 g蔗糖是1 mol。而溶液的体积——1 L水溶解342 g蔗糖后的体积无从知晓,故不能得出蔗糖溶液的准确的物质的量浓度。
2.从1 L 1 mol·L-1的蔗糖溶液中取出100 mL,则取出的溶液中蔗糖的物质的量浓度仍是1 mol·L-1。
[师]回答得很正确!这也告诉我们在理解物质的量浓度的概念时要注意以下两点:
1.溶液的体积不等于溶剂的体积;且不同物质(尤其是不同状态的物质)的体积是没有加和性的。
2.溶液的物质的量浓度与所取溶液的体积大小无关。这与从一坛醋中取出一勺,其酸度不变是同一个道理。
[问]在初中我们讲分子的概念时,曾做过一个实验:100 mL酒精与100 mL水混合其体积并不等于200 mL,它说明了什么?结合初中和我们今天所学的知识进行回答。
[生]说明了分子之间有间隔;同时也说明不同物质的体积是没有加和性的。
[师]很好!同样的例子我们可以举出很多:如通常状况下,1体积水中可溶解约500体积的氯化氢气体,但所得盐酸溶液的体积并不等于(1+500)体积,而是远小于501体积。一般来说,固体与液体,液体与液体混合时,形成混合液的体积变化不大,而气体与液体混合时,体积变化较大。在计算时,我们一般通过混合液的质量和密度来求得溶液的体积。因为相同物质或不同物质的质量是有加和性的。
[过渡]既然物质的量浓度和溶质的质量分数都是用来表示溶液组成的物理量,那么,它们之间又有什么样的区别和联系呢?
请同学们根据学过的知识,填写下表。
[投影]物质的量浓度和溶质质量分数的区别
物质的量浓度 | 溶质质量分数 | |
溶质单位 | ||
溶液单位 | ||
表达式 | ||
特点 | 体积相同,物质的量浓度相同的不同物质的溶液中,所含溶质的物质的量,溶质质量(填“相同”“不同”或“不一定相同”) | 质量相同、溶质质量分数相同的不同物质的溶液中,溶质的质量,物质的量(“相同”“不同”或“不一定相同”) |
[学生活动,请一位同学把答案填写在胶片上]
[答案]
mol | g | |
L | g | |
cB=n(B)/V(液) | w=m(质)/m(液)×100% | |
相同;不一定相同 | 相同;不一定相同 |
[讲解]溶质的质量分数与溶质的物质的量浓度除了有上面我们所分析的区别外,它们在使用范围上也有较大差别。由于我们在许多场合取用溶液时,一般不去称它的质量,而是要量取它的体积,且物质在发生化学反应时,各物质的物质的量之间存在着一定的关系,而化学反应中各物质之间的物质的量的关系要比它们的质量关系简单得多。因此,物质的量浓度是比质量分数应用更广泛的一种物理量。
[悬念]那么,在物质的量浓度和溶质的质量分数之间有着什么样的联系呢?下一节课,我们将解开这个谜!
[小结]本节课我们主要学习了物质的量浓度的概念及其简单计算,同时也知道了溶质的物质的量浓度与质量分数之间是有区别的。
[布置作业]略
[参考练习]
1.对1 mol·L-1的Na2SO4溶液的叙述中正确的是()
A.溶液中含有1 molNa2SO4
B.1 L溶液中含有142 gNa2SO4
C.1 molNa2SO4溶于1 L水
D.将322 gNa2SO4·10H2O溶于少量水后再稀释成1000 mL
解析:A项未说明溶液体积是多少,而1 molNa2SO4怎样求得无从知晓,故错误,误选此项的同学主要是因为混淆了物质的量与物质的量浓度的概念;B项正确;C项1 molNa2SO4溶于水配成1 L溶液时,其物质的量浓度才为1 mol·L-1,而C项给的1 L是水的体积,故不正确;D项322 gNa2SO4·10H2O中含Na2SO4的物质的量恰是1 mol,且溶液体积为1000 mL即1 L,故正确。此项若不清楚结晶水合物Na2SO4·10H2O,溶于水时,溶质为Na2SO4则易漏选。
答案:BD
2.已知在含有MgCl2、KCl和K2SO4的混合溶液中各种离子的物质的量浓度分别为:
c(K+)=0.9mol·L-1,c(Cl-)=1.1 mol·L-1,c(Mg2+)=0.3mol·L-1。求c(SO42-)=?
解析:解此类题可利用溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,即电荷守恒定律。依题意,有
c(K+)+2c(Mg2+)=c(Cl-)+2c(SO42-)
即c(SO42-)=[c(K+)+2c(Mg2+)-c(Cl-)]/2
=(0.9mol·L-1+2×0.3 mol·L-1-1.1 mol·L-1)/2
=0.2 mol·L-1。
答:SO42-的物质的量浓度为0.2 mol·L-1。
【板书设计】
第三节物质的量浓度(第一课时)
一、物质的量浓度
以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:c(B)
c(B)= n(B)/V(液)
单位:mol·L-1(或mol/m3)
1.将28.4 gNa2SO4溶于水配成250 mL溶液,计算溶液中溶质的物质的量浓度,并求出溶液中Na+和SO 的物质的量浓度。
解:n(Na2SO4)=m(Na2SO4)/M(Na2SO4)=28.4g/142g·mol-1=0.2 mol
c(Na2SO4)=n(Na2SO4)/V[Na2SO4(aq)]=0.2 mol/0.25L =0.8mol·L-1
因为Na2SO4====2Na++SO
故溶液中:n(Na+)=2n(Na2SO4)=2×0.2 mol=0.4 mol
n(SO42-)=n(Na2SO4)=0.2 mol,
则c(Na+)=n(Na+)/V[Na2SO4(aq)]=0.4 mol/0.25L =1.6mol·L-1;
c(SO42-)=n(SO42-)/V[Na2SO4(aq)]=0.2mol/0.25L =0.8mol·L-1。
答:所配溶液中溶质的物质的量浓度为0.8 mol·L-1,Na+和SO42-的物质的量浓度分别为1.6 mol·L-1和0.8 mol·L-1。
 爱华网
爱华网