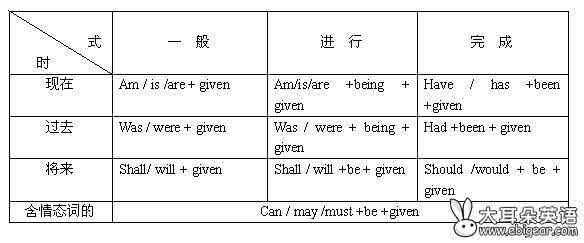
第四单元 物质构成的奥秘
[考点梳理]
考点26 原子的构成
⒈ 构成原子的粒子
质子:一个质子带一个单位的正电荷
原子核
原子 (+) 中子:不带电
(不显电性) 核外电子:一个电子带一个单位的负电荷
(-)
⒉ 表4-2 几种原子的组成
原子的
种类
核电
荷数
原 子 核
核外电子数
质子数
中子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
铁
26
26
30
26
从上表中可获得以下信息:
①、在原子里,核电荷数=质子数=核外电子数,
②、质 子 数 不 一 定 等 于 中 子 数
③、原 子 中 不 一 定 含 有 中 子
④、质子数不同,原子种类不同。 既质子数决定了原子的种类
考点27 相对原子质量(Ar)
⒈定 义:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比,作为这种原子的相对原子质量。
⒉计 算 公 式: 相对原子质量(Ar) = 某原子的实际质量/C原子质量的1/12
注意: ①.相对原子质量只是一个比,不是原子的实际质量。它的单位是1,省略不写 。
②.在相对原子质量计算中,所选用的是一种含6个质子和6个中子的碳原子,它质量的1/12约等于1.66×10-27 kg。
③.相对原子质量是一个比值,不是原子的实际质量。
⒊原子的质量主要集中在原子核上,相对原子质量≈质子数+中子数
考点28 元素
⒈ 元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。
⒉ 元素的种类决定于核电荷数(即核内质子数)。
⒊ 地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多非金属元素是氧,含量最多的金属元素是铝。
4.生物细胞中含量列前四位的元素:氧、碳、氢、氮。
5. 元素、原子的区别和联系 (见下表)
元 素
原 子
区别
A.是从宏观角度表明物质组成的概念
例:水是由氢元素和氧元素组成的。
A.是从微观角度表明物质构成的概念
例:一个水分子,是由两个氢原子和一个氧原子构成的。
B.只可论种类,不能论个数和质量
B.即可论种类,也可论个数和质量
C. 是粒子的总称
C. 粒子;
联系
具有相同核电荷数(质子数)的同一类原子(或离子)总称为同一种元素
考点29 元素符号
⒈元素符号:用拉丁文名称表示。
⒉书写: ⑴由一个字母表示的元素符号要大写,如:H、O、S、C、P等。
⑵由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”),如:Ca、Na、Mg、Zn等。
⒊元素符号表示的意义:⑴表示一种元素;
⑵表示这种元素的一个原子。:
⑶若在元素符号前加数字, 只表示这种元素的一个原子
①表示氢元素
例如: H ②表示一个氢原子 2H:表示二个氢原子
4. 书写并记住1—18号元素及常见元素的符号
5、元素的分类 金属元素 “钅”字旁
非金属元素 固态非金属元素 “石”字旁
液态非金属元素 “氵”字旁
气态非金属元素 “气”字头
考点30 元素周期表简介
⒈ 根据元素的原子结构和性质,把它们科学有序地排列起来,就得到了元素周期表元素周期表按元素原子核电荷数递增的顺序给元素编了号,叫做原子序数,原子序数与元素原子核电荷数在数值上相同。
2.元素周期表的结构 原子序数 元素符号
(核电荷数) ———— 元素名称
相对原子质量----------
⑴周期表每一横行叫做一个周期,共有7个周期。
⑵周期表每一个纵行叫做一族,共有16个族(8、9、10三个纵行共同组成一个族)。
3.元素周期表的意义
⑴是学习和研究化学知识的重要工具;
⑵为寻找新元素提供了理论依据;
⑶由于在元素周期表中位置越靠近的元素,性质越相似,可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料等)。
考点31 核外电子的分层排布
1、1~18号元素元素的原子结构示意图表示
金属元素、非金属元素、稀有气体元素的最外层电子一般为多少?
2.原子的最外层电子数与元素的分类、化学性质的关系
元素的分类
最外层电子数
得失电子趋势
化学性质
结论
元素的化学性质决定于原子的最外层电子数
稀有气体元素
8个(氦为2个)
相对稳定,不易得失电子
稳定
金属元素
一般少于4个
易失去最外层电子
不稳定
非金属元素
一般多于4个
易得到电子
不稳定
(注:原子最外层电子数为8(氦为2)的结构称为稳定结构。)
3.原子结构示意图含义:(以钠原子结构示意图为例)
各部分的意义:圆圈表示原子核,圆圈内的数字表示质子数,弧线表示电子层,弧线上数字为该电子层上的电子数 。
原子核
电子层上的电子数
质子数(或核电荷数)
电子层
考点32 离子
⒈定义:带电荷的原子(或原子团)。
⒉分类
阳离子:带正电荷的离子,如Na+、Mg2+
离子
阴离子:带负电荷的离子,如Cl-、O2-
⒊离子符号表示的意义:表示离子(或一个离子),如:
Mg2+——表示镁离子(一个镁离子)
2Mg2+ 表示每个镁离子带两个单位的正电荷
表示两个镁离子
注:离子符号前面的化学计量数(系数)表示离子的个数;
4.离子符号的表示方法——离子符号。
离子符号表示式Xn+或Xn-,X表示元素符号或原子团的化学式,X右上角的“+”或“-”表示离子带的是正电荷还是负电荷,“n”表示带n个单位的电荷。例如,Al3+表示1个铝离子带3个单位正电荷;3SO42-表示3个带两个单位负电荷的硫酸根离子。
若离子带1个单位的正电荷或个单位的负电荷,“1”省略不写。
如: 阳离子:Na+ 阴离子:Cl-
5.常见原子团离子: SO42- 硫酸根离子 CO32- 碳酸根离子 NO3- 硝酸根离子
OH- 氢氧根离子 NH4+ 铵根离子
6.离子与原子的区别与联系
即:原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电) 阴离子中:质子数<</SPAN>电子数(带负电)
考点33 化学式
1.定义: 用元素符号和数字来表示物质组成的式子。
2.化学式的写法
气态非金属单质用双原子分子表示如:氢气—H2,氧气—O2,氮气—N2,
A. 单质
直接用元素符号来表示 稀有气体:如氦--He,氖—Ne,氩--Ar
金属: 如铁—Fe,铜—Cu,镁--Mg
大多数固态非金属单质:磷—P,硫—S,碳--C
B.化合物的化学式 正价写左边,负价写右边,同时正、负化合价的代数和为零。
氧化物中另一种元素在前,氧元素在后,如:CO2 MgO P2O5
⒊ 化学式的涵义(以CO2为例说明)
表示一种物质:表示二氧化碳。
⑴宏观上
表示该物质由哪些元素组成:表示二氧化碳由碳元素和氧元素组成。
表示该物质的一个分子:表示一个二氧化碳分子。
⑵微观上
表示分子的构成:表示每个二氧化碳分子由一个碳原子和二个氧原子构成。
注:若在化学式前加数字,就只表示微观意义. 如: 2CO2只表示两个二氧化碳分子
4.几点注意事项
⑴一种物质只有一个化学式,书写化学式时,要考虑到元素的排列顺序,还要考虑到表示原子个数的角码应写的部位。
⑵一般化合物的中文名称,读法和书写的顺序正好相反。
考点34 化合价
⒈元素化合价的表示方法及与离子表示方法的区别.
⒉ 元素化合价的一般规律
⑴氢元素的化合价通常显+1价,氧元素的化合价显-2价。
⑵在化合物中,金属元素为正价,非金属元素一般为负价.
⑶非金属与氢或金属化合时,非金属元素显负价;
非金属与氧元素化合时,非金属元素显正价。
⑷在化合物中,正、负化合价的代数和为零。
⑸在单质中元素的化合价为零。
⒊牢记常见元素的化合价: 或
一价氢氟钾钠银, 一价钾、钠、氯、氢、银
二价氧钙钡镁锌, 二价氧、钙、钡、镁、锌
三铝四硅五价磷, 三铝 四硅 五氮,磷
二三铁,二四碳, 谈变价,也不难
二四六硫三五氮, 二、三铁, 二,四碳
铜汞二价最常见, 二、四、六硫都齐全
一五七氯都齐全, 铜、汞二价最常见
单质零价永不变。 氢一(+1)氧二(-2)为标准
单质价态总为零.
⒋常见根(原子团)的化合价
根的名称
铵根
氢氧根
硝酸根
硫酸根
碳酸根
磷酸根
离子符号
NH4+
OH-
NO3-
SO42-
CO32-
PO43-
化合价
+1
-1
-1
-2
-2
-3
⒌化合价的应用
⑴检验化学式的正误;
⑵根据化学式判断元素的化合价;
⑶根据元素的化合价推求实际存在物质的化学式。
6.一些数字的含义:
①、元素符号前的数字:表示原子个数 2N
②、化学式前面的数字:表示分子个数 2H2O
③、离子符号前面的数字:表示离子个数
④、元素符号右上角的数字:表示该离子所带的电荷数 Mg2+
⑤、元素符号正上方的数字:表示该元素的化合价
⑥、化学式中元素符号右下角的数字:表示该分子所含有的某原子个数 H2O
考点35 有关化学式的计算
⒈计算物质的相对分子质量(Mr)=各元素的(相对原子质量×原子个数)之和
例 计算5CuSO4·5H2O的相对分子质量总和。
5CuSO4·5H2O=5×[64+32+16×4+5×(1×2+16)]
=5×[160+5×18] =1250
⒉计算物质组成元素的质量比=各元素的相对原子质量×原子个数之比
例: 计算氧化铁中铁元素和氧元素的质量比。
氧化物的化学式:Fe2O3,则
m( Fe)∶m(O)=56×2∶16×3=112∶48=7∶3
3.原子个数比:脚标比
4.元素质量比: 相对原子质量×原子个数比
5.计算物质中某元素的质量分数
例:计算硝酸铵(NH4NO3)中,含氮元素的质量分数。
w(N)=N的相对原子质量 X 原子个数 / NH4NO3 的相对分子质量 ×100%
=14 X 2 / 14 X 2 + 1 X 4 +16 X 3 X 100%
=35%
6.计算一定质量的化合物中含某元素的质量
某元素的质量=化合物的质量×化合物中该元素的质量分数
变形:化合物的质量=某元素的质量÷化合物中各元素的质量分数
第五单元 化学方程式
[考点梳理]
考点36 质量守恒定律
⒈质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
⒉质量守恒定律的分析归纳:
原子的种类不变
原子的数目不变
五个不变 原子的质量不变
元素的种类不变
反应物和生成物总质量不变
元素的质量不变
物质种类一定改变
两个一定改变
分子的种类一定改变
一个可能改变——分子总数可能改变
⒊关键词的理解
⑴“参加化学反应的”:所给予物质不一定都参加反应,若反应物有剩余,剩余的物质没有参加反应。所以必须强调“参加化学反应”,
⑵“质量总和”: 是参加化学反应的物质的质量总和和反应后生成的物质的质量总和。
如:镁在氧气中燃烧生成氧化镁,参加反应的镁的质量和参加反应的氧气的质量的和等于反应后生成的氧化镁的质量。
(3) 质量守恒定律只能用于解释化学变化。
⒋探究质量守恒定律的几个重要实验
⑴白磷燃烧前后质量的测定(P88)
⑵铁钉跟硫酸铜溶液反应前后质量的测定(P89)
⑶蜡烛燃烧前后质量的测定(P90)
⑷镁条燃烧(P91)
⒌质量守恒定律的应用
⑴根据质量守恒定律进行简单的计算;
⑵运用质量守恒定律解释化学反应中的一些简单的现象和问题;
⑶判断化学反应中某种物质的组成;
⑷确定化学反应中某种物质的化学式。
考点37 化学方程式
⒈定义:用化学式表示化学反应的式子。
⒉化学方程式提供的信息(意义或含义)
⑴哪些物质参加了反应(反应物是什么)
⑵生成了哪些物质(生成物是什么)
⑶反应条件
⑷反应物与生成物之间的质量比
⑸反应物与生成物之间的粒子数量比
⒊化学方程式的读法 (以C + O2 点燃===== CO2为例)
⑴质:碳和氧气在点燃的条件下反应生成二氧化碳;
⑵量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳;
⑶粒子:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子。
4. 化学方程式的书写
A.书写原则:⑴以客观事实为基础;⑵要遵守质量守恒定律。
B.书写步骤 ⑴写:根据事实写出反应物和生成物的化学式,中间用短横线相连;
⑵配:配平化学方程式;
⑶等;将短横线改为等号;
⑷标:标明反应条件以及生成物的状态“↑”或“↓”。
⑸查:检查化学式是否写错、是否配平、条件和生成物状态是否标了、标了是否恰当。
考点3 8 根据化学方程式的计算
⒈解题步骤及格式:
一般分为以下七步:⑴解设未知量,一般情况下,求什么设什么;
⑵写出相应的正确的化学方程式;
⑶根据化学方程式找出相关物质的相对分子质量,列在相应的化学式下面; ⑷标出已知量和未知量;
⑸列比例式;
⑹求解;⑺答题。
⒉计算中常用的关系式
⑴m= ρv
⑵单位换算:1L=1000mL,1mL=1cm3
⑶物质的纯度=纯物质的质量/不纯物质的质量×100%
变形:纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=纯物质的质量÷物质的纯度
⑷物质的纯度(纯物质的质量分数)=1-杂质的质量分数
⒊常见的计算类型
⑴利用化学方程式的简单计算;
⑵有关含杂质物质的化学方程式的计算;
⑶质量守恒定律结合化学方程式的综合计算。
考点39、化学反应类型
1、四种基本反应类型
①化合反应:由两种或两种以上物质生成另一种物质的反应
②分解反应:由一种反应物生成两种或两种以上其他物质的反应
③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应
2、氧化还原反应
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
氧化剂:提供氧的物质
还原剂:夺取氧的物质(常见还原剂:H2、C、CO)
3、中和反应:酸与碱作用生成盐和水的反应
 爱华网
爱华网