Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)题型:填空题难度:偏难来源:不详
Ⅰ.(1)B NaHA只能发生电离,不能发生水解
(2)BC
(3)BD
Ⅱ.(1)Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
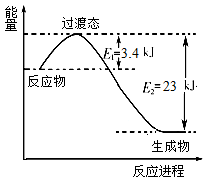
(2)3.0×10-6mol·L-1H2A在水中的一级电离进行完全,则HA-不水解只电离,故NaHA溶液呈酸性。HA-在水中部分电离,0.1 mol·L-1的NaHA溶液中c(H+)小于0.1 mol·L-1,加入0.1 mol·L-1KOH溶液至溶液呈中性时消耗的KOH溶液体积小于NaHA溶液体积,则混合溶液中c(Na+)>c(K+);由电荷守恒知,c(Na+)+c(K+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),且c(H+)=c(OH-),则c(Na+)+c(K+)=c(HA-)+2c(A2-);水的离子积与温度有关;混合液中c(Na+)>0.05 mol·L-1;降温、增大c(A2-)都能使平衡CaA(s)Ca2+(aq)+A2-(aq)左移。废水中加入绿矾和H+,根据流程图,可知发生的是氧化还原反应,配平即可。c(Cr3+)/c(Fe3+)=[c(Cr3+)·c3(OH-)]/[c(Fe3+)·c3(OH)-]=Ksp[Cr(OH)3]/Ksp[Fe(OH)3]=1.5×10-7,故c(Cr3+)=3.0×10-6mol·L-1。
考点:
考点名称:氧化还原反应的配平配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx0→-2 降2×2
S20→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
一般方法:从左向右配。步骤:标变价,找变化,求总数,配系数。标出元素化合价变化的始态和终态求升价元素或降价元素化合价的变化数求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数配平变价元素用观察法配平其他元素检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)如:
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
 爱华网
爱华网