发布时间:2018年04月10日 20:06:47分享人:那算什么来源:互联网14
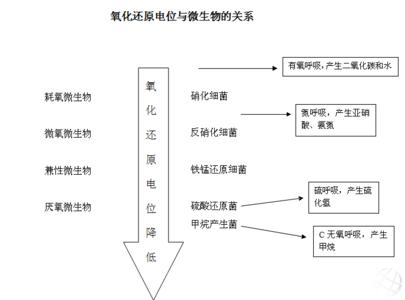
衡量电极反应趋势的参数和判断氧化还原反应能否进行的依据。又称电极电势。
氧化还原电势
oxidation-reductionpotential
衡量电极反应趋势的参数和判断氧化还原反应能否进行的依据。又称电极电势。当一个金属电极浸在该金属的一种盐溶液中时,金属中的原子有离开晶格,转变为金属正离子进入溶液的倾向;溶液中的金属离子也有在金属电极的表面还原为原子而沉积的趋势。这样,在电极表面上因聚积电子而带负电,靠近电极表面的溶液中可能聚积着金属离子而带正电,因而在电极和溶液之间存在着一定的电势差。现在采用的氧化还原电势都是相对值,将1×10帕的氢气所饱和的铂片与浓度为1摩尔/升的氢离子溶液之间的电势差规定为零,即规定下列还原反应的平衡电势等于零:
2+2eH2
然后将其他物质与相应的溶液所构成的电极直接或间接地与标准氢电极组成化学电池,进行测定对比,求得它们的电势。当在1×10帕压力下和溶液中M离子的浓度为1摩尔/升时,电池的电势便是标准电势。
表:标准还原电势(酸性溶液,20℃)
一种物质的还原电势越大,表明它越容易还原,即该物质越容易从其他物质获取电子,并将其他物质氧化,本身是越强的氧化剂。表中最下面所列的一些半反应中,左侧都是强氧化剂。最上面所列的那些半反应中,右侧的物质都是强还原剂。
爱华网本文地址 » http://www.aihuau.com/a/8103430103/95275.html
更多阅读
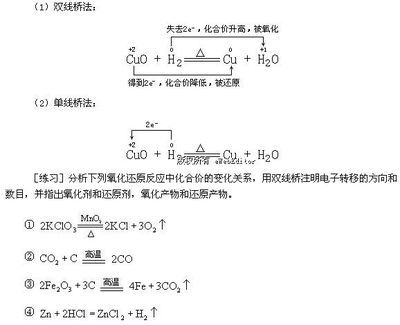
课题:人教版高中化学必修一第二章第三节《氧化还原反应》第一课时教学设计思路:氧化还原反应的知识在高中化学中占有极其重要的地位和作用。要想准确把握氧化还原反应的知识,就必须准确把握两条知识脉络:其一,准确把握氧化还原反应知识在

谷胱甘肽的水平及氧化还原状态与炎症性肠病的关系北京市武警总医院南一科王英,罗敏,李卉,张菁,魏巍,高娃,李嵘,邓馨北京协和医院消化内科 张静氧化还原反应(redoxreactions)是细胞新陈代谢和动态平衡中的一个完整的部分。在氧化还原反应
有关氧化还原反应的问题古田一中胡嘉谋 氧化还原反应是每年高考的热点,也是高中化学反应中与离子反应并存的一大支柱。考查内容主要是氧化还原反应的概念和规律、氧化性和还原性的判断、氧化还原反应原理的综合应用等。一、思维要
化合价 氧化数1.定组成定律罗蒙诺索夫(俄,1711—1765)和拉瓦锡分别用天平做定量实验后,就认为化合物有一定的组成。但这个论断经过多年的争论,直到1799年,经法国的一位药剂师普罗斯(J.L.Proust,1754—1826)又用许多实验证明以后,才最后作
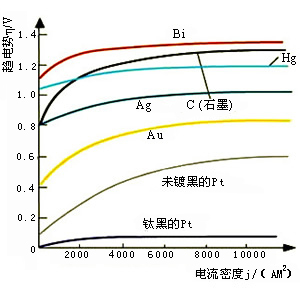
简单与复杂电极反应标准电极电势值间的关系与简单电极反应不同,当电极反应中不仅有某氧化态及某还原态物种,同时还与沉淀平衡、或配合平衡、或电离平衡等有关时,这种电极反应可被称为复杂电极反应。复杂电极反应的标准电极电势计算

 爱华网
爱华网


